Hydrolyse

Cet article concernant la chimie doit être recyclé ().
Une réorganisation et une clarification du contenu paraissent nécessaires. Améliorez-le, discutez des points à améliorer ou précisez les sections à recycler en utilisant {{section à recycler}}.


Cet article ne cite pas suffisamment ses sources ().
Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références ».
En pratique : Quelles sources sont attendues ? Comment ajouter mes sources ?
Une hydrolyse (du grec hydro : eau et lysis : briser) est une réaction chimique et enzymatique dans laquelle une liaison covalente est rompue par action d'une molécule d'eau.
Exemple :
- hydrolyse du saccharose : saccharose + eau → glucose + fructose[1] : ce mélange porte le nom de sucre inverti[2] ;
- hydrolyse d'un ester : ester + eau → alcool + acide carboxylique : en utilisant les formules semi-développées cette réaction peut s'écrire R1-COO-R2 + H2O → R2-OH + R1-COOH. La réaction inverse est l'estérification.
Effets biochimiques
Pour des substances organiques telles que les protéines, une hydrolyse équivaut à la coupure des liaisons peptidiques entre les différents acides aminés qui les constituent.
Les acides aminés sont coupés par les enzymes. Ainsi en est-il de l'hydrolyse de l’amidon ou amylolyse, utilisée en brasserie ou de manière générale dans l'industrie agroalimentaire pour obtenir du sirop de glucose.
À titre d'exemple, lors de la cuisson d'une viande, le collagène ne peut se transformer en gélatine qu'en présence d'eau.
Substances hydrolysables
Presque toutes les macromolécules biologiques peuvent être hydrolysées, ce qui libère les monomères qui les constituent. Par exemple, les protéines peuvent être hydrolysées et libérer des acides aminés. Les polymères comme le glycogène peuvent être hydrolysés pour donner du glucose. L'ADN et l'ARN peuvent être hydrolysés pour libérer les nucléotides.
Parmi les fonctions hydrolysables, nous trouvons les esters, les acétals (présents dans les polysaccharides) et les amides (présents dans les protéines).
Taux de conversion d'une hydrolyse
L'hydrolyse d'un ester par de l'eau est une réaction lente et limitée. En effet, il se forme des produits qui sont des acides et des alcools, qui eux-mêmes réagissent ensemble dans le milieu réactionnel pour former à leur tour de l'ester et de l'eau. Le taux de conversion d'une hydrolyse d'ester lors de l'introduction des réactifs en quantités stœchiométriques est de l'ordre de 33 % quand il forme un alcool primaire, 40 % pour un secondaire et 95 % pour un tertiaire. Un excès d'eau déplace logiquement cet équilibre vers la formation de l'alcool.
Hydrolyse acide

La réaction est aidée par la présence d'un acide.
Hydrolyse basique
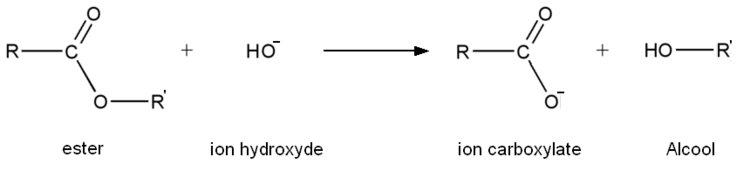
L'hydrolyse basique est, comme son nom l'indique, une réaction d'hydrolyse. Mais, contrairement à une hydrolyse classique, l'eau est remplacée généralement par de la soude ou toute autre solution contenant des ions hydroxyde (comme de l'hydroxyde de potassium par exemple), d'où le nom d'hydrolyse basique car la réaction d'hydrolyse se déroule en milieu basique.
L'équation générale d'une réaction d'hydrolyse basique est la suivante :
L'ion carboxylate (contrairement à l'acide carboxylique formé lors d'une hydrolyse classique) est sans effet sur l'alcool de sorte que la réaction inverse d'estérification n'a pas lieu. Par conséquent une transformation d'hydrolyse basique est totale contrairement à une hydrolyse classique. Une hydrolyse basique est lente à température ambiante mais rapide à chaud.
Une application de l'hydrolyse basique est la formation de savons. En effet, les réactions de saponification à l'origine des savons ne sont autres que des réactions d'hydrolyse basique à partir de corps gras (qui sont des triesters du glycérol). Les savonnettes sont obtenues par précipitation de l'ion carboxylate obtenu lors de la saponification à l'aide de sodium ou de potassium. Les savons sont des carboxylates de sodium ou de potassium.
Notes et références
- ↑ K. Thomas Klasson, Matthew P. Sturm et Marsha R. Cole, « Acid hydrolysis of sucrose in sweet sorghum syrup followed by succinic acid production using a genetically engineered Escherichia coli », Biocatalysis and Agricultural Biotechnology, vol. 39, , p. 102231 (ISSN 1878-8181, DOI 10.1016/j.bcab.2021.102231, lire en ligne, consulté le )
- ↑ Rodrigo Lira de Oliveira, Vinícius Luís Vilela dos Santos, Marcos Fellipe da Silva et Tatiana Souza Porto, « Kinetic/thermodynamic study of immobilized β-fructofuranosidase from Aspergillus tamarii URM4634 in chitosan beads and application on invert sugar production in packed bed reactor », Food Research International, vol. 137, , p. 109730 (ISSN 0963-9969, DOI 10.1016/j.foodres.2020.109730, lire en ligne, consulté le )
Voir aussi
Sur les autres projets Wikimedia :
- Hydrolyse, sur Wikimedia Commons
Articles connexes
Liens externes
Bibliographie

 Portail de la chimie
Portail de la chimie