Phénol (composé)

Ne doit pas être confondu avec Acide carbonique.

Pour les articles homonymes, voir Phénol.
| Phénol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure du phénol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | phénol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes | Acide phénique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 108-95-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.003.303 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 203-632-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03255 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 996 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3223 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | c1(ccccc1)O PubChem, vue 3D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | InChI : vue 3D InChI=1/C6H6O/c7-6-4-2-1-3-5-6/h1-5,7H | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | cristaux incolores à jaunes ou rose clair, d'odeur caractéristique[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C6H6O [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[4] | 94,111 2 ± 0,005 5 g/mol C 76,57 %, H 6,43 %, O 17 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | pKa(PhOH2+/PhOH) = -6,4 pKa(PhOH/PhO−) = 9,95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dipolaire | 1,224 ± 0,008 D[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diamètre moléculaire | 0,557 nm[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | 43 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 182 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | 76,04 g·l-1 d'eau | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètre de solubilité δ | 25,1 J1/2·cm-3/2 (40 °C)[3] ; 11,4 cal1/2·cm-3/2[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,073 g·cm-3[6] équation[7] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 715 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 79 °C (coupelle fermée)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 1,36–10 %vol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 20 °C : 47 Pa[1] équation[7] :
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 61,3 bar, 694,2 K[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
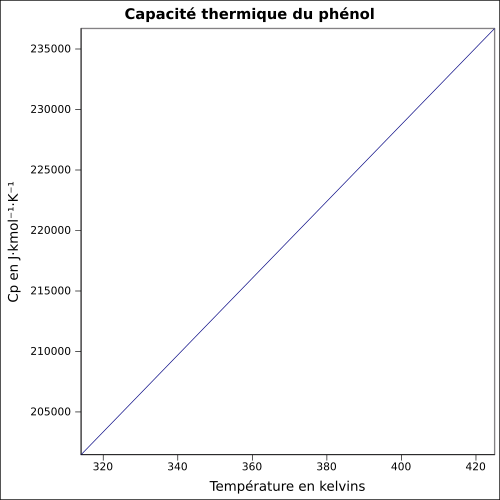
| Cp | équation[7] :
équation[9] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 3 053,5 kJ·mol-1 (25 °C, solide)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe cristalline ou groupe d’espace | P1121[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètres de maille | a = 6,050 Å b = 8,925 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 788,01 Å3[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction | 1,5427[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Danger H301 : Toxique en cas d'ingestion H311 : Toxique par contact cutané H314 : Provoque de graves brûlures de la peau et des lésions oculaires H331 : Toxique par inhalation H341 : Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H373 : Risque présumé d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  D1A, E, D1A : Matière très toxique ayant des effets immédiats graves Transport des marchandises dangereuses : classe 6.1 groupe II E : Matière corrosive nécrose de la peau chez l'animal Divulgation à 1,0 % selon la liste de divulgation des ingrédients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 4 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[15] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 1671 : PHÉNOL SOLIDE Classe : 6.1 Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage II : matières moyennement dangereuses ;
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 2312 : PHÉNOL FONDU Classe : 6.1 Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage II : matières moyennement dangereuses ;
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 2821 : PHÉNOL EN SOLUTION Classe : 6.1 Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage II/III : matières moyennement/faiblement dangereuses. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,46[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 0,004 5 ppm haut : 1 ppm[16] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le phénol, appelé aussi hydroxybenzène, acide phénique, ou encore acide carbolique, est un hydrocarbure aromatique composé d'un noyau phényle et d'une fonction hydroxyle. C'est la plus simple molécule de la famille des phénols.
Représentations
-
 Modèle compact.
Modèle compact. -
 Modèle boules et bâtonnets.
Modèle boules et bâtonnets.
Histoire
Le phénol est découvert à l'état impur par le chimiste allemand Johann Rudolf Glauber au milieu du xviie siècle, à partir de la distillation du goudron de houille. Glauber décrit le composé comme « une huile vive et rouge sang qui assèche et guérit tous les ulcères humides »[17].
En 1834, Friedrich Ferdinand Runge parvient à l'isoler et le nomme alors acide carbolique.
En 1836, Auguste Laurent invente le terme « phène » pour benzène[18] ; ceci est la racine des termes « phénol » et « phényl ».
En 1841, le chimiste français Auguste Laurent l'obtient dans une forme pure[19].
De 1865 aux années 1880, le phénol est utilisé comme antiseptique sous l'impulsion de Joseph Lister, permettant de réduire le taux de mortalité lors des opérations chirurgicales de 65 % à 20 %.
Le phénol est synthétisé et manufacturé, en 1889, par la firme BASF.
Énol
Le phénol est aussi un énol (dérivé alcoolique dont la fonction alcool est portée par un atome de carbone hybridé sp2). Il est la forme tautomère de la cyclohexa-2,4-diènone. Mais contrairement à la majorité des énols, il est la forme la plus stable comparé à sa cétone tautomère, stabilité due en majorité à la présence d'un cycle aromatique non présent dans la cétone correspondante.

Propriétés physiques

Le phénol a une constante molale cryoscopique de 6,84 °C∙kg/mol et une constante molale ébullioscopique de 3,54 °C∙kg/mol.
De couleur blanche à l'état pur, il a tendance à s'oxyder légèrement au contact de l'air pour donner des traces de quinones qui le colorent en rose, puis en rouge.
Production
En 2005, le phénol a été produit à hauteur de 8,8 millions de tonnes dans le monde, dont environ 26 % aux États-Unis et 2 % en France. Le principal producteur est Ineos Phenol[20] (Royaume-Uni) avec une capacité de production de 1,6 million de tonnes[21].
Le phénol est produit aujourd'hui à plus de 85 % par le procédé au cumène. Ce procédé, mis au point en 1944 par Hock[22] et Lang[23], est utilisé depuis les années 1950[21]. Son avantage réside dans la simplicité de sa mise en œuvre, son bon rendement (90 %) et le fait d'obtenir phénol et acétone à partir du cumène, disponible en grande quantité par pétrochimie. Il consiste en une oxydation du cumène par l'air fournissant l'hydroperoxyde de cumène en tant qu'intermédiaire qui, en milieu aqueux acide, donne du phénol et de l'acétone.
Utilisation
- Les deux tiers de la production de phénol sont utilisés pour produire des plastiques (polycarbonates, résines époxyde).
- Intermédiaire important pour de nombreuses synthèses de produits pharmaceutiques. Voir Phénol (groupe).
- En parfumerie : thymol, estragol, eugénol, vanilline, etc.
- En médecine, il est surtout utilisé comme antiseptique puissant. Il est aussi utilisé en dermatologie dans le traitement des ongles incarnés (phénolisation)[24].
- En biologie moléculaire, le phénol est utilisé pour éliminer les protéines dans les protocoles d'extraction d'acides nucléiques.
- Préparation de la phénolphtaléine, un indicateur pH-métrique bien connu des chimistes.
- Par action du chlore gazeux sur le phénol, on obtient des chlorophénols, tels le 2,4,6-trichlorophénol.
- Utilisé en entomologie pour la conservation des planches d'insectes contre les moisissures.
- En alimentation, pour la conservation de la viande.
- Le phénol est utilisé pour la production de papier.
- En combinaison avec l'acide sulfurique concentré, il est utilisé comme méthode de coloration des glucides pour leur dosage par spectrophotométrie[25],[26].
Sécurité
Le phénol est fortement corrosif pour les organismes vivants. Une solution aqueuse à 1 % suffit à provoquer des irritations sévères.
Les brûlures au phénol sont très douloureuses et longues à guérir. De plus, elles peuvent être suivies de complications graves pouvant mener à la mort par la toxicité de ce composé et sa capacité à pénétrer dans l’organisme en traversant la peau.
Ces propriétés font du phénol un agent de mutilations génitales féminines. En effet, le Dr Kellogg préconisait la brûlure au phénol du clitoris comme « remède » contre la masturbation[27].
Durant la Seconde Guerre mondiale, des prisonniers d'Auschwitz et d'autres camps ont été exécutés par une piqûre de phénol dans le cœur. Maximilien Kolbe a été tué par une injection de phénol dans le bras après quatorze jours de détention sans nourriture. Le médecin SS Karl Babor officiant dans le camp de Gross-Rosen était spécialiste de l'assassinat à la seringue de phénol.
Articles connexes
Les substances suivantes sont des composés organiques simples dérivés du phénol :
- Crésol, phénol substitué par un groupe méthyle (3 isomères de position)
- Xylénol, phénol substitué par deux groupes méthyle (6 isomères de position)
- Benzènediol, phénol substitué par un deuxième groupe hydroxyle pour former l'un des trois isomères de position :
- Pyrocatéchol (catéchol), isomère ortho
- Résorcine (résorcinol), isomère méta
- Hydroquinone, isomère para
- Benzènetriol, phénol substitué par deux groupes hydroxyle supplémentaires, donnant aussi trois isomères de position :
- Pyrogallol, avec les substituants en position 1,2,3
- Hydroxyquinol, avec les substituants en position 1,2,4
- Phloroglucinol, avec les substituants en position 1,3,5
- Benzènetétrol (en)
- Benzènepentol (en)
- Benzènehexol
Notes et références
- ↑ a b c d e f g et h PHENOL, Fiches internationales de sécurité chimique .
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- ↑ a b et c (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Royaume-Uni, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Șerban Moldoveanu, Sample preparation in chromatography, Elsevier, , 930 p. (ISBN 0-444-50394-3), p. 258.
- ↑ (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289.
- ↑ a b et c (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ « Properties of Various Gases »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur flexwareinc.com (consulté le ).
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- ↑ a b et c (en) « Phenol », sur reciprocalnet.org (consulté le ).
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, (consulté le ).
- ↑ Numéro index 604-001-00-2 (en) dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 ().
- ↑ « Phénol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- ↑ Entrée « Phenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 août 2009 (JavaScript nécessaire).
- ↑ (en) « Phenol », sur hazmap.nlm.nih.gov (consulté le ).
- ↑ Johann Rudolph Glauber, Opera Chymica, t. II, Götze, (lire en ligne), partie II, chap. 44
- ↑ Auguste Laurent, Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique, , Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage.
- ↑ Annales de chimie et de physique, V. Masson (Paris), 1816-1913 (lire en ligne).
- ↑ (en) Site institutionnel.
- ↑ a et b Données sur la production industrielle de phénol, Société chimique de France, 8e éd., 2009.
- ↑ Heinrich Hock (1887-1971) est un chimiste allemand, formé à l'université technique de Munich par Karl Andreas Hofmann. Il enseigna de 1927 à 1958 à l'Institut des Charbonnages de Mülheim, puis la chimie des explosifs à l'École des Mines de Clausthal.
- ↑ Shon Lang était le collègue de Heinrich Hock à Clausthal.
- ↑ « Ongle incarné traitement par phénolisation de l'ongle incarné avec e-sante.fr », sur e-sante.fr (consulté le ).
- ↑ (en) Michel. DuBois, K. A. Gilles, J. K. Hamilton et P. A. Rebers, « Colorimetric Method for Determination of Sugars and Related Substances », Analytical Chemistry, vol. 28, no 3, , p. 350–356 (ISSN 0003-2700 et 1520-6882, DOI 10.1021/ac60111a017, lire en ligne, consulté le ).
- ↑ S. Suzanne Nielsen, « Phenol-Sulfuric Acid Method for Total Carbohydrates », dans Food Analysis Laboratory Manual, Springer US, (ISBN 9781441914620, DOI 10.1007/978-1-4419-1463-7_6, lire en ligne), p. 47–53.
- ↑ (en) John Harvey Kellogg, Plain Facts for Old and Young, , 644 p. (ISBN 978-0-405-05808-0).
v · m | |
|---|---|
| Antihémorroïdal pour usage topique |
|
| Traitement antivarice |
|
| Stabilisateurs de capillaires |
|
 Portail de la chimie
Portail de la chimie  Portail de la pharmacie
Portail de la pharmacie