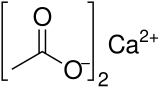
酢酸カルシウム
| 酢酸カルシウム | |
|---|---|
 | |
 酢酸カルシウム結晶 | |
別称 Acetate of lime Calcium ethanoate | |
| 識別情報 | |
| 略称 | Ca(OAc)2 |
| CAS登録番号 | 62-54-4  , 5743-26-0 (monohydrate) , 5743-26-0 (monohydrate)  |
| PubChem | 6116 |
| ChemSpider | 5890  |
| UNII | Y882YXF34X  , 7ZA48GIM5H (monohydrate) , 7ZA48GIM5H (monohydrate)  |
| EC番号 | 269-613-0 |
| E番号 | E263 (防腐剤) |
| DrugBank | DB00258 |
| KEGG | D00931  |
| ChEBI |
|
| ChEMBL | CHEMBL1200800  |
| RTECS番号 | AF7525000 |
| バイルシュタイン | 3692527 |
| Gmelin参照 | 22320 |
| |
| |
| 特性 | |
| 化学式 | C4H6CaO4 |
| モル質量 | 158.17 g mol−1 |
| 外観 | 白色の固体 吸湿性 |
| 匂い | わずかな酢酸臭 |
| 密度 | 1.509 g/cm3 |
| 融点 | 160 °C, 433 K, 320 °F [2](decomposition to CaCO3 + acetone) |
| 水への溶解度 | 37.4 g/100 mL (0 °C) 34.7 g/100 mL (20 °C) 29.7 g/100 mL (100 °C) |
| 溶解度 | メタノールにやや溶けにくい、 アセトン、エタノール、ベンゼン、ヒドラジンに溶けない |
| 酸解離定数 pKa | ca. 0.7 |
| 磁化率 | -70.7·10−6 cm3/mol |
| 屈折率 (nD) | 1.55 |
| 危険性 | |
| NFPA 704 |  1 1 0 |
| 発火点 | 680 - 730 °C (1,256 - 1,346 °F; 953 - 1,003 K) |
| 半数致死量 LD50 | 4280 mg/kg (経口、ラット) |
| 関連する物質 | |
| その他の陽イオン | 酢酸マグネシウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酢酸カルシウム(さくさんカルシウム、英: calcium acetate)は、酢酸とカルシウムの塩。CAS登録番号は [5743-26-0]。無水物と一水和物がよく知られるが、無水物は吸湿性が強いため、通常取り扱われるのは一水和物である。一水和物はわずかに吸湿性がある白色の結晶あるいは結晶性粉末で、無臭またはわずかな酢酸臭がある。水に易溶、エタノールに難溶。
製造法
酢酸カルシウムは、炭酸カルシウム(卵殻、または石灰岩や大理石などの一般的な炭酸塩岩に含まれる)または水酸化カルシウムに酢酸を入れると出来る、この性質を利用して酢や木酢液から酢酸を分離する為の中間物質として作られる場合もある。
両方の試薬が先史時代に利用可能だったので結晶は古くから観察されていた。
性質
160℃で分解し、アセトンと炭酸カルシウム[4][5][3]になる。
実験室的方法としてこの方法で酢酸カルシウムを乾留することでアセトンが得られる。 また、さらに強熱し続けると生じた炭酸カルシウムが分解し、酸化カルシウムと二酸化炭素になる。[4][3][5]
利用
酢酸カルシウムは国際的に食品添加物として安定剤、増粘剤等に汎用されている。日本の厚生労働省は2013年に本物質を認可した。[6]
参考文献
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. pp. 801. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4
- ^ Dale L. Perry (May 19, 2011). Handbook of Inorganic Compounds (Second ed.). Taylor & Francis. p. 84. ISBN 978-1-4398-1461-1. https://books.google.com/books?id=SFD30BvPBhoC&pg=PA84
- ^ a b c 『スクエア最新図説化学七訂版』第一学習社、2019.1.10.。
- ^ a b c 『化学事典』旺文社、2010年。
- ^ a b c 『日本大百科全書(ニッポニカ)』小学館、2014年。
- ^ “酢酸カルシウムの食品添加物の指定に関する部会報告書”. 厚生労働省. 2023年3月22日閲覧。
| |
|---|---|
| 二元化合物 | |
| 三元化合物 |
|
| 四元・五元化合物 |
|
| |
- 表示
- 編集











