Fosfoserine
| Fosfoserine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
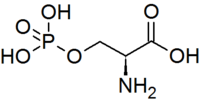 | ||||
Structuurformule van fosfoserine | ||||
| Algemeen | ||||
| Molecuulformule | C3H8NO6P | |||
| IUPAC-naam | (S)-2-amino-3-(fosfono-oxy)propaanzuur | |||
| Andere namen | fosfoserine | |||
| Molmassa | 185,073 g/mol | |||
| SMILES | O=P(O)(O)OC[C@@H](C(=O)O)N | |||
| CAS-nummer | 407-41-0 | |||
| PubChem | 106 | |||
| Wikidata | Q2701649 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| EG-Index-nummer | 206-986-0 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Smeltpunt | 228 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Fosfoserine (afgekort als SEP of J) is een ester van serine en fosforzuur. Fosfoserine is een bestanddeel van een groot aantal proteïnes, het wordt in een posttranslationele modificatie van serine in de proteïneketen geïntroduceerd.[1] De fosforylering van de alcoholfunctie in serine wordt door verschillende enzymen, kinases, gekatalyseerd.[2][3] Via technieken die gebruik maken van een uitgebreidere genetische code kan fosfoserine ook tijdens de translatie al in de aminozuurketen worden opgenomen.[4][5][6]
Fosfoserine is een standaard metaboliet in (menselijke) lichaamsvloeistoffen.[7]
Fosfoserine is een tridentaat ligand: de carbonzuur-, de amine- en de fosfaat-groep. Het vaststellen van de manier waarop een metaalion in een gefosforyleerde verbinding gecoördineerd is in een organisme, is de eerste stap in het verklaren van de functie van fosfoserine in biologische processen.[8][9]
Bronnen, noten en/of referenties
|









