Tetróxido de xenônio
| Tetróxido de xenônio Alerta sobre risco à saúde | |
|---|---|
 |  |
| Nome IUPAC | Tetraóxido de xenônio Óxido de xenônio (VIII) |
| Outros nomes | Tetróxido de xenônio |
| Identificadores | |
| Número CAS | 12340-14-6 |
| ChemSpider | 21106492 |
| SMILES |
|
| InChI | 1/O4Xe/c1-5(2,3)4 |
| Propriedades | |
| Fórmula molecular | |
| Massa molar | 195.29 g mol−1 |
| Aparência | Amarelo Sólido Baixa intensidade −36°C |
| Densidade | ? g cm−3, Sólido |
| Ponto de fusão | −35.9 °C |
| Ponto de ebulição | 0 °C[1] |
| Estrutura | |
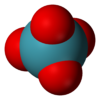
| Forma molecular | Tetraédrica[2] |
| Momento dipolar | 0 D |
| Termoquímica | |
| Entalpia padrão de formação ΔfH | +153.5 kcal mol−1 [3] |
| Entropia molar padrão S | ? J.K−1.mol−1 |
| Riscos associados | |
| Classificação UE | Explosivo  |
| Compostos relacionados | |
| Compostos relacionados | Ácido Perxênico Trióxido de Xenônio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Tetróxido de xenônio é um composto químico de xenônio e oxigênio com fórmula molecular XeO4, notável por ser um composto relativamente estável de um gás nobre. É um sólido amarelo cristalino que é estável abaixo de -35,9 °C , acima dessa temperatura ele é muito propenso a explodir, decompondo-se em xenônio e oxigênio ().[4][5]
Todos os oito elétrons de valência do átomo de de xenônio estão envolvidos nas ligações com o oxigênio, e o estado de oxidação do átomo de xenônio é +8. O oxigênio é o único elemento que pode trazer o xenônio até o seu estado de oxidação mais alto, mesmo o flúor só consegue formar o .
Reações
Em temperaturas acima de -35,9 °C, tetróxido de xenônio é muito propenso a explosão, decompondo-se em xenônio gasoso e oxigênio com :
- é um óxido ácido e, ao reagir com água forma o instável ácido perxênico (, e ao reagir com bases forma o perxenato correspondente:
Também se conhece os compostos e , instáveis e que também apresentam com número de oxidaçãode +8. Eles são obtidos pela reação do tetróxido de xenônio com o .[6]
Síntese
Todas as sínteses começam a partir dos perxenatos, que são acessíveis a partir dos xenatos através de dois métodos. Um deles é o desproporcionamento de uma solução básica de xenatos para perxenatos e :
Outro é a oxidação de uma solução básica de xenato pelo ozônio:
O tetróxido de xenônio pode ser obtido pelo tratamento da solução de perxenato resultante com um sal de Bário formando precipitado de perxenato de bário que é combinado com ácido sulfúrico formando o ácido perxênico instável e sulfato de bário. O ácido perxênico formado é desidratado formando XeO4.
O ácido perxênico formado pela reação do com ou resultante da reação de uma solução de perxenato é instável e lentamente sofre dismutação em ácido xênico e oxigênio:
- .
Referências
- ↑ Lide, David R. (1998). Handbook of Chemistry and Physics 87 ed. Boca Raton, FL: CRC Press. 494 páginas. ISBN 0-849-30475-X. OCLC 30677089
Lide, David R. (1999). CRC handbook of chemistry and physics : CRCnetBASE 1999. Boca Raton, FL: Chapman & Hall/CRCnetBASE. ISBN 0-849-39720-0. OCLC 41485442 - ↑ G. Gundersen, K. Hedberg, J. L.Huston (1970). «Molecular Structure of Xenon Tetroxide, XeO4». J. Chem. Phys. 52 (2): 812–815. doi:10.1063/1.1673060 !CS1 manut: Nomes múltiplos: lista de autores (link)
- ↑ Gunn, Stuart R. (1 de maio de 1965). «The Heat of Formation of Xenon Tetroxide1». Journal of the American Chemical Society. 87 (10): 2290-2291. ISSN 0002-7863. doi:10.1021/ja01088a038
- ↑ H.Selig , J. G. Malm , H. H. Claassen , C. L. Chernick , J. L. Huston (1964). «Xenon tetroxide -Preparation + Some Properties». Science. 143 (3612). 1322 páginas. JSTOR 1713238. PMID 17799234. doi:10.1126/science.143.3612.1322 !CS1 manut: Nomes múltiplos: lista de autores (link)
- ↑ J. L. Huston, M. H. Studier, E.N. Sloth (1964). «Xenon tetroxide - Mass Spectrum». Science. 143 (3611). 1162 páginas. JSTOR 1712675. PMID 17833897. doi:10.1126/science.143.3611.1161-a !CS1 manut: Nomes múltiplos: lista de autores (link)
- ↑ Housecroft, C. E. (2008). Inorganic chemistry (em inglês) 3 ed. Harlow (Inglaterra): Pearson Education Limited. ISBN 978-0-13-175553-6 Parâmetro desconhecido
|coautori=ignorado (ajuda)
Nota
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Xenon tetroxide», especificamente desta versão.

 Portal da química
Portal da química
 | Este artigo sobre Química é um esboço. Você pode ajudar a Wikipédia expandindo-o. |




























