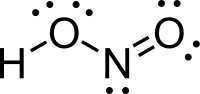
Azotasta kiselina
 | |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv Nitrous acid | |
| Sistemski IUPAC naziv Hidroksidooksidoazot | |
| Identifikacija | |
| |
3D model (Jmol) |
|
| 3DMet | B00022 |
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.057 |
| EC broj | 231-963-7 |
| Gmelin Referenca | 983 |
| KEGG[1] |
|
| MeSH | Nitrous+acid |
| |
SMILES
| |
| Svojstva | |
| HNO2 | |
| Molarna masa | 47,013 g/mol |
| Agregatno stanje | bledo plavi rastvor |
| Gustina | Približno 1 g/ml |
| Tačka topljenja | Poznata je samo u rastvoru |
| Kiselost (pKa) | 3.398 |
| Opasnosti | |
| Tačka paljenja | nije zapaljiva |
| Srodna jedinjenja | |
Drugi anjoni | Azotna kiselina |
Drugi katjoni | Natrijum nitrit Kalijum nitrit Amonijum nitrit |
Srodna jedinjenja | Diazot trioksid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
 Y verifikuj (šta je Y verifikuj (šta je  Y Y Н ?) Н ?) | |
| Reference infokutije | |
Azotasta kiselina (nitritna kiselina) je jedinjenje sa molekulskom formulom HNO2). Ona je slaba i monobazina kiselina koja je poznata samo u rastvoru i u obliku nitritnih soli.[4][5]
Azotasta kiselina se koristi za pravljenje diazida iz amina. Do toga dolazi nukleofilnim napadom amina na nitrit, reprotonacijom uz pomoć rastvarača, i dvostrukom eliminacijom u vodi. Diazid se zatim oslobađa i daje karben ili karbenoid.
Struktura
U gasovitoj fazi, planarni molekul azotaste kiseline može da poprimi cis i trans formu. Trans forma je predominatna na sobnoj temperaturi, i IR merenja ukazuju da je stabilnija za oko 2.3 kJ mol−1.[6]
 | 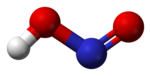 | 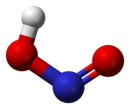 |
(sa mikrotalanog spektra) |
Priprema
Azotasta kiselina se pravi opreznom zakišeljavanjem hladnih razblaženih rastvora nitritnog jona, NO2−. Slobodna azotasta kiselina je nestabilna i brzo se razlaže.
Razlaganje
Osim u veoma razblaženim, hladnim rastvorima, azotasta kiselina se brzo razlaže u azot dioksid, azot monoksid, i vodu:
- 2 HNO2 → NO2 + NO + H2O
Azot dioksid se disproporcioniše u azotnu kiselinu i azotastu kiselinu u vodenom rastvoru:[7]
- 2 NO2 + H2O → HNO3 + HNO2
U toplim ili koncentrisanim rastvorima, sveukupna reakcija dovodi do formiranja azotne kiseline, vode, i azot oksida:
- 3 HNO2 → HNO3 + 2 NO + H2O
Reference
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003. уреди
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Kameoka Yohji, Pigford Robert (1977). „Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous”. Ind. Eng. Chem. Fundamen. 16 (1): 163—169. doi:10.1021/i160061a031.
Spoljašnje veze









