Blastulatie




Blastulatie is het stadium in de embryonale ontwikkeling waarin de blastula wordt gevormd. Bij de ontwikkeling van zoogdieren ontwikkelt de blastula zich tot de blastocyste met een gedifferentieerde innerlijke celmassa en een buitenste trofoblast. Na de vorming van deze blastocyste volgt de gastrulatie. Bij de andere meercellige dieren vindt direct na de blastulatie de gastrulatie plaats.
De blastula (uit het Grieks:βλαστό (blastos) betekent spruit)) is een holle bol van blastomeren die een binnenste met vloeistof of dooier gevulde holte omringen die de blastocoel wordt genoemd.[1] De embryonale ontwikkeling begint met de bevruchting van de eicel tot een zygote, die klievingen ondergaat om zich te ontwikkelen tot een bol van cellen die de morula wordt genoemd. Pas wanneer de blastocoel wordt gevormd, wordt het embryo een blastula genoemd. Bij een sterroblastula ontbreekt de holte echter, die voorkomt bij bloemdieren, eikelwormen en pindawormen. Ook bij de stereoblastula, die bestaat uit een geheel van grotere en relatief kleinere cellen, ontbreekt de holte of is zeer klein. Deze komt voor bij onder andere insecten, Nereis, Crepidula, wormsalamanders en bepaalde vissen.
De blastula gaat vooraf aan de vorming van de gastrula waarin de kiembladen van het embryo worden gevormd.[2]
Een gemeenschappelijk kenmerk van een blastula bij gewervelden is dat deze bestaat uit een laag blastomeren, bekend als het blastoderm, die de blastocoel omringt.[3][4] Bij zoogdieren bevat de blastocyste een embryoblast (of binnenste celmassa) die uiteindelijk aanleiding zal geven tot de definitieve structuren van de foetus, en een trofoblast die vervolgens de extra-embryonale weefsels, zoals samen met het baarmoederslijmvlies de placenta (moederkoek) en het amnion (vruchtvlies), vormt.[2][5]
Tijdens de blastulatie wordt in het embryo de celpolariteit, celspecialisatie en asvorming bepaald en wordt de genexpressie gereguleerd.[6] Bij veel organismen, zoals Drosophila en Xenopus is de middenblastula (MBT) een cruciale stap in de ontwikkeling waarbij het moederlijk mRNA wordt afgebroken en de controle over de ontwikkeling wordt doorgegeven aan het embryo.[7] Veel van de interacties tussen blastomeren zijn afhankelijk van de expressie van cadherine, met name E-cadherine bij zoogdieren en EP-cadherine in amfibieën. Bij zoogdieren is er geen midblastula vorming.
De studie van de blastula en van de celspecificatie heeft veel gevolgen voor het stamcelonderzoek en de kunstmatige bevruchting.[8] Door de celsignalen tijdens het ontwikkelingsstadium van de blastula te manipuleren, kunnen verschillende weefsels worden gevormd. Dit potentieel kan een belangrijke rol spelen in regeneratieve geneeskunde bij ziekte- en letselgevallen. In-vitrofertilisatie omvat de transfer van een embryo naar een baarmoeder voor implantatie.[9]
Ontwikkeling
Het blastula stadium in de embryonale ontwikkeling begint met het verschijnen van de blastocoel. Er is aangetoond dat de blastocoel in Xenopus laevis al bij de eerste klievingsgroef wordt gevormd door verbreding van de groef en afdichting met tight junctions waardoor een vloeistofdichte holte gevormd wordt.[10]
Bij veel organismen wordt de ontwikkeling van het embryo tot op dit punt en gedurende het eerste deel van het blastula stadium gecontroleerd door moederlijk mRNA, zo genoemd omdat het vóór de bevruchting in de eicel werd geproduceerd en daarom uitsluitend van de moeder afkomstig is.[11][12]
Middenblastula stadium

Bij veel organismen, waaronder Xenopus en Drosophila, vindt het middenblastula stadium gewoonlijk plaats na een bepaald aantal celdelingen voor een bepaalde soort, en wordt gedefiniëerd door het einde van de synchrone celdelingscycli van de vroege blastula-ontwikkeling en de verlenging van de celcycli door de uitbreiding met de G1- en de G2-fase. Voorafgaand aan dit stadium vindt klieving plaats met alleen de S- of synthese- en mitosefase van de celcyclus. [12] Door de toevoeging van de twee groeifasen aan de celcyclus kunnen de cellen in omvang toenemen, aangezien tot dit punt de blastomeren zich deelden waarbij de totale grootte van het embryo niet toenam, maar er meer cellen werden aangemaakt. In het middenblastula stadium begint de omvang van het embryo toe te nemen.[2]
Het middenblastula stadium wordt ook gekenmerkt door een duidelijke toename van de transcriptie van nieuw, niet-moederlijk mRNA getranscribeerd met het genoom van het embryo. Grote hoeveelheden moederlijk mRNA worden op dit punt afgebroken, hetzij door eiwitten zoals SMAUG in Drosophila[13] of door microRNA[14] Deze twee processen verschuiven de controle over het embryo van het moederlijke mRNA naar de celkernen van het embryo. In dit stadium wordt de expressie van vaderlijke genen voor het eerst waargenomen.
Tijdstip van begin middenblastula stadium
Het tijdstip van het begin van het middenblastula stadium varieert tussen verschillende organismen. Bij de zebravis is dit in de tiende celcyclus,[15] maar bij zowel Xenopus als Drosophila is dit de dertiende celcyclus. Er wordt gedacht dat cellen het middenblastula stadium beginnen door de kern/cytoplasmatische verhouding te meten, wat de verhouding is tussen het volume van de kern, die DNA bevat, en het volume cytosol. Bewijs voor deze hypothese komt uit experimenten die aantonen dat het begin van het middenblastula stadium kan worden versneld door extra DNA toe te voegen[16] voor het groter maken van de celkern, of door de hoeveelheid cytoplasma te halveren. De exacte methoden waarmee de cel deze controle uitvoert is onbekend, maar er wordt aangenomen dat er eiwitten in het cytosol betrokken zijn.
In Drosophila en de zebravis is de zinkvingertranscriptiefactor Zelda gebonden aan regulerende regio's van genen die door de zygote tot expressie worden gebracht.[17] Het homeobox-eiwit Pou5f3 (een homoloog van het zoogdier-POU5F1 (OCT4) speelt een vergelijkbare rol.[18] Bij het niet functioneren van deze eiwitten is de synchronisatie van de genexpressie van het begin middenblastula stadium verstoord, maar bepaalde mechanismen voor het coördineren van het begin van de genexpressie zijn nog onbekend maar worden wel bestudeerd.
Structuur
Een blastula is een bol van cellen die een met vloeistof gevulde holte omringen die de blastocoel wordt genoemd. De blastocoel bevat aminozurenen, eiwiten, groeifactoren, koolhydraten, ionen en andere componenten die nodig zijn voor celdifferentiatie. De blastocoel zorgt er ook voor dat blastomeren kunnen bewegen tijdens het proces van gastrulatie.[19]
Een amfibie-embryo in het 128-celstadium wordt een blastula genoemd, omdat het blastocoel in het embryo tijdens dit stadium duidelijk zichtbaar wordt. In Xenopus laevis-embryo's bestaat de blastula uit drie verschillende regio's (kiembladen). De dierlijke pool vormt de bovenkant van de blastocoel en vormt vervolgens voornamelijk ectoderme weefsels. De equatoriale of marginale zone, waaruit de wanden van het blastocoel bestaan, differentiëren voornamelijk in mesodermweefsel. De vegetatieve pool zit aan de blastocoelonderkant en ontwikkelt zich voornamelijk tot endodermweefsel.[6]
Cellulaire adhesie
Tight junctions zijn erg belangrijk bij de ontwikkeling van embryo's. In de blastula zijn deze door cadherine ondersteunde celinteracties essentieel voor de ontwikkeling van epitheel, wat het belangrijkst is voor het paracellulaire transport (overdracht van stoffen door een epitheel door de intercellulaire ruimte tussen de cellen), het behoud van de celpolariteit en het creëren van een vloeistofafdichting om de vorming van de blastocoel te reguleren. Deze nauwe verbindingen ontstaan nadat de polariteit van epitheelcellen is bepaald, wat de basis vormt voor verdere ontwikkeling en specificatie. Binnen de blastula zijn de binnenste blastomeren over het algemeen niet-polair, terwijl epitheelcellen polariteit vertonen.[19]
Zoogdierembryo's ondergaan compactering rond het 8-cellige stadium waarin zowel E-cadherinen als alpha- en beta-cateninen tot expressie komen. Dit proces creëert een bol van embryonale cellen die in staat zijn tot interactie, in plaats van een groep diffuse en ongedifferentieerde cellen. E-cadherine-adhesie definieert de apico-basale as in het zich ontwikkelende embryo en verandert het embryo van een onduidelijke bol cellen in een meer gepolariseerd fenotype, wat de weg vrijmaakt voor verdere ontwikkeling naar een volledig gevormde blastocyste.[19]
Xenopus laevis-membraanpolariteit wordt bepaald bij de eerste klieving. EP-cadherine en XB/U-cadherine van amfibieën vervullen een vergelijkbare rol als E-cadherine bij zoogdieren, waarbij blastomeerpolariteit tot stand wordt gebracht en cel-cel-contacten worden versterkt die cruciaal zijn voor verdere ontwikkeling.[19]
Transcriptiefactoren bij de blastulatie van de mens
Tijdens de blastulatie worden verschillende transcriptiefactoren tot expressie gebracht voor het reguleren van de genexpressie en de celdifferentiatie. De vijf belangrijke transcriptiefactoren zijn: NANOG, Oct4, GATA-6, CDX2 en SOX2. NANOG en Oct4 komen tot expressie in de binnenste celmassa en zorgen voor het behoudt van pluripotente stamcellen door de celdeterminatiefactoren te onderdrukken. GATA-6 is een zinkvingertranscriptiefactor en komt tot expressie in de trofoblastlaag en is belangrijk voor de vorming van de placenta en de endodermdifferentiatie van orgaanweefsels. CDX2 komt ook tot expressie in de trofoblastlaag en is belangrijk voor de scheiding van de binnenste celmassa en van de trofoblastcellen. De activiteit van CDX2 is essentieel voor de juiste vorming van de darm en de anus. CDX2 is ook nodig voor de ontwikkeling van de placenta. SOX2 komt bij zoogdieren zowel tot expressie in de binnenste celmassa als de trofoblastlaag en speelt een cruciale rol bij het in stand houden van embryonale en neurale stamcellen.[20]
Klinische implicaties
Bevruchtingstechnologieën
Experimenten met implantatie van embryo's bij muizen laten zien dat inductie van de ovulatie, gecontroleerde ovariële hyperstimulatie en kunstmatige inseminatie met succes pre-implantatie-muizenembryo's produceren. Bij de muizen werd negentig procent van de vrouwtjes door kunstmatige stimulatie aangezet tot een pseudozwangerschap, waarbij ten minste één embryo werd geïmplanteerd.[21] Deze resultaten blijken bemoedigend te zijn omdat ze een basis vormen voor mogelijke implantatie van embryo's in andere zoogdiersoorten, zoals de mens.
Stamcellen
Cellen in het blastula stadium kunnen zich bij veel soorten gedragen als pluripotente stamcellen. Pluripotente stamcellen vormen het startpunt voor de productie van orgaanspecifieke cellen die mogelijk kunnen helpen bij het herstel en de preventie van letsel en degeneratie. Het combineren van de expressie van transcriptiefactors en locatiegebonden positionering van de blastula cellen kan leiden tot de ontwikkeling van geïnduceerde functionele organen en weefsels. Pluripotente Xenopus laevis-cellen waren, wanneer ze in een in vivo strategie werden gebruikt, in staat zich te vormen tot functionele netvliescellen. Door ze te transplanteren naar het oogveld op de neurale plaat, en door verschillende afwijkende expressies van transcriptiefactoren te induceren, werden de cellen gecommitteerd aan de afstamming van het netvlies en konden ze het op zicht gebaseerde gedrag in de Xenopus laevis sturen.[22]
Afbeeldingen
-
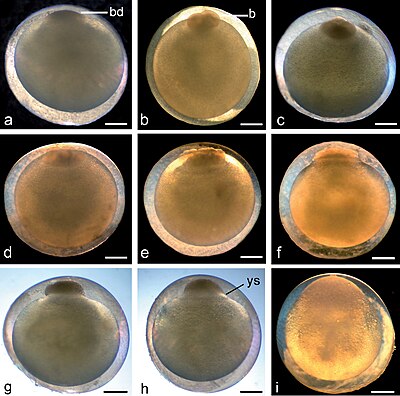 Klieving bij Aziatische mesvis en sterroblastula-vorming. (a) Fase 1: één cel (zygote) met vorming van blastodisc (bd), 1 uur: 10 minuten; (b) Fase 2: twee blastomeren (b), om 2.00 uur; (c) Fase 3: vier cellen, 2 uur: 20 minuten; (d) Fase 4: acht cellen, 2 uur: 42 minuten; (e) Fase 5: vroege morula met 16 cellen, 3 uur: 45 minuten; (f) Fase 6: asynchrone blastomeren tot circa 32 cellen, 4 uur: 30 minuten; (g) Fase 7: blastula met compacte knopachtige blastodisc, 6 uur: 25 minuten; (h) Fase 8: platte blastula met uitzettende dooierzak syncytium (ys), ronde top van het blastoderm op de bovenkant van de dooier, 7:40; (i) Stadium 9: late blastula, het oppervlak van blastoderm lijkt glad en bedekt een deel van de dooier, maar de cellen zijn nog steeds duidelijk te onderscheiden, 8 uur: 35 minuten. Schaalbalk = 1 mm.
Klieving bij Aziatische mesvis en sterroblastula-vorming. (a) Fase 1: één cel (zygote) met vorming van blastodisc (bd), 1 uur: 10 minuten; (b) Fase 2: twee blastomeren (b), om 2.00 uur; (c) Fase 3: vier cellen, 2 uur: 20 minuten; (d) Fase 4: acht cellen, 2 uur: 42 minuten; (e) Fase 5: vroege morula met 16 cellen, 3 uur: 45 minuten; (f) Fase 6: asynchrone blastomeren tot circa 32 cellen, 4 uur: 30 minuten; (g) Fase 7: blastula met compacte knopachtige blastodisc, 6 uur: 25 minuten; (h) Fase 8: platte blastula met uitzettende dooierzak syncytium (ys), ronde top van het blastoderm op de bovenkant van de dooier, 7:40; (i) Stadium 9: late blastula, het oppervlak van blastoderm lijkt glad en bedekt een deel van de dooier, maar de cellen zijn nog steeds duidelijk te onderscheiden, 8 uur: 35 minuten. Schaalbalk = 1 mm. -
 Embryonale ontwikkeling van Pseudorasbora parva: (2) Bevrucht ei; (3) Het volledig gezwollen ei (A, blastoderm); (4) Blastodiscvorming; (5) De eerste klievingsgroef (B, klievingsgroef); (6) 2-celfase; (7) De tweede klievingsgroef (B, klievingsgroef); (8) 4-celfase; (9) fase met 8 cellen; (10) fase met 16 cellen; (11) fase met 32 cellen; (12) fase met 64 cellen; (13) Cellulousfase; (14) Morula-fase; (15) Vroege blastulafase; (16) Middenblastulafase; (17) Late blastulafase (C, epibolycellen); (18) Vroege gastrulafase (D, kiemring); (19) Middengastrulafase (D, kiemring); (20) Late gastrulafase (D, kiemring); (21) Neurale embryovorming (E, blastopore); (22) Blastopore gesloten fase; (23) Somiet-uiterlijk (F, somiet); (24) Uiterlijk van het optische blaasje (G, optisch blaasje); (25) Uiterlijk van de optische capsule; (26) Notochord-uiterlijk (H, notochord); (27) Uiterlijk van de staartknop (I, staartknop); (28) Uiterlijk van de otische blaasjes; (29) Vorming van kristallijne lenzen; (30) Spierfunctiefase; (31) Uiterlijk van de hartknop (J, hartknop); (32) Hartslagfase; (33) Otoliet-uiterlijk (K, otoliet); (34) Uiterlijk van oogpigment; (35) Uiterlijk van de borstvinknop (L, borstvinknop); (36) Uiterlijk van lichaamspigment (M, lichaamspigment); (37) Profase van uitkomen; (38) Uitkomstfase (N, dooierzak); (39) Pas uitgekomen larve. Schaalbalken: 2–37 = 0,2 mm, 38–39 = 0,5 mm.
Embryonale ontwikkeling van Pseudorasbora parva: (2) Bevrucht ei; (3) Het volledig gezwollen ei (A, blastoderm); (4) Blastodiscvorming; (5) De eerste klievingsgroef (B, klievingsgroef); (6) 2-celfase; (7) De tweede klievingsgroef (B, klievingsgroef); (8) 4-celfase; (9) fase met 8 cellen; (10) fase met 16 cellen; (11) fase met 32 cellen; (12) fase met 64 cellen; (13) Cellulousfase; (14) Morula-fase; (15) Vroege blastulafase; (16) Middenblastulafase; (17) Late blastulafase (C, epibolycellen); (18) Vroege gastrulafase (D, kiemring); (19) Middengastrulafase (D, kiemring); (20) Late gastrulafase (D, kiemring); (21) Neurale embryovorming (E, blastopore); (22) Blastopore gesloten fase; (23) Somiet-uiterlijk (F, somiet); (24) Uiterlijk van het optische blaasje (G, optisch blaasje); (25) Uiterlijk van de optische capsule; (26) Notochord-uiterlijk (H, notochord); (27) Uiterlijk van de staartknop (I, staartknop); (28) Uiterlijk van de otische blaasjes; (29) Vorming van kristallijne lenzen; (30) Spierfunctiefase; (31) Uiterlijk van de hartknop (J, hartknop); (32) Hartslagfase; (33) Otoliet-uiterlijk (K, otoliet); (34) Uiterlijk van oogpigment; (35) Uiterlijk van de borstvinknop (L, borstvinknop); (36) Uiterlijk van lichaamspigment (M, lichaamspigment); (37) Profase van uitkomen; (38) Uitkomstfase (N, dooierzak); (39) Pas uitgekomen larve. Schaalbalken: 2–37 = 0,2 mm, 38–39 = 0,5 mm.
Bronnen, noten en/of referenties
|













