Metan
| Metan | |
 | |
 | |
 | |
| Nume IUPAC | Metan Carban (nerecomandat) |
|---|---|
| Alte denumiri | Tetrahidrură de carbon |
| Identificare | |
SMILES C | |
| Număr CAS | 74-82-8 |
| ChEMBL | CHEMBL17564 |
| PubChem CID | 297 |
| Informații generale | |
| Formulă chimică | CH4 |
| Aspect | gaz incolor |
| Masă molară | 16,04 g |
| Proprietăți | |
| Densitate | 0,656 g/L (25 °C, 1 atm) |
| Punct de topire | −182,5 °C |
| Punct de fierbere | −161,49 °C |
| Solubilitate | etanol, eter dietilic, benzen, toluen, metanol, acetonă |
| Solubilitate în apă | |
| 22,7 mg/L | |
| Miros | inodor |
| Temperatură de aprindere | −188 °C |
| Pericol | |
  | |
| Fraze R | R12 |
| Fraze S | S2, S9, S16, S33 |
  Pericol H220 : Gaz extrêmement inflammable P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. | |
| NFPA 704 | |
4 2 0 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
Modifică date / text  | |
Metanul este cel mai simplu compus organic, cu formula CH4, și primul reprezentant din clasa alcanilor, fiind astfel și cea mai simplă hidrocarbură aciclică saturată. Este componentul principal al gazelor naturale, fiind relativ răspândit în natură. Metanul natural este răspândit în subteran și sub nivelul fundului mării, dar se găsește în cantități mai mici și în atmosferă.[1] Metanul este un gaz cu efect de seră cu o pondere destul de mare, contribuind la încălzirea atmosferei terestre.[2]
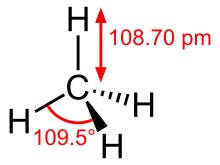
Molecula metanului are geometrie tetraedrică și este formată dintr-un atom central de carbon, legat de patru atomi de hidrogen prin legături covalente sigma. Este un gaz incolor și inodor, solubil în solvenți organici și insolubil în apă. Metanul este utilizat ca și combustibil dar este și un punct de plecare în sinteza organică, având unele căi de chimizare.
Istoric
Metanul a fost descoperit de fizicianul italian Alessandro Volta în noiembrie 1778 în mâlul găsit în Lacul Maggiore, iar din această cauză a fost numit inițial gaz de baltă. Volta s-a inspirat în a căuta acest compus după ce a citit o lucrare scrisă de Benjamin Franklin referitoare la așa-numitul „aer inflamabil”.[3] Volta a colectat gazul ce se degaja din mlaștină, iar în 1778 a reușit să-l izoleze în stare pură.[4]
Denumirea utilizată astăzi de „metan” a fost introdusă în 1866 de către chimistul german August Wilhelm von Hofmann, numele fiind derivat de la metanol.[5]
Proprietăți fizice și structură

Metanul este unul dintre cele mai cunoscute exemple de compus a cărui moleculă să aibă geometrie tetraedrică. Altfel spus, molecula metanului este formată din patru legături sigma echivalente carbon-hidrogen (C-H), iar structura sa electronică este descrisă prin patru orbitali moleculari rezultați în urma întrepătrunderii orbitalilor de valență ai carbonului și atomilor de hidrogen.
În condiții normale de temperatură și presiune, metanul este un gaz incolor, inodor, mai ușor decât aerul.[6] Mirosul neplăcut și ușor de recunoscut al gazului natural folosit în locuințe se datorează unor aditivi odoranți, precum terț-butiltiolul, care sunt folosiți pentru siguranță. Metanul are un punct de fierbere de −161 °C la o presiune de o atmosferă.[7]
Metanul este puțin solubil în apă (sub 1%), dar solubil în alcool și eter. Arde cu flacără puțin luminoasă, cu degajare mare de căldură (8560 kcal/m3). Amestecul de metan și oxigen (sau metan și aer) explodează în prezența unei scântei. Așa se explică exploziile care se produc uneori în minele de cărbuni, unde se găsesc cantități însemnate de metan sub formă de gaz grizzu.
Proprietăți chimice
Principalele reacții chimice pe care le dă metanul sunt arderea (combustia), reacția de formare a gazului de sinteză și halogenarea fotochimică.[8] În general, aceste reacții sunt greu de controlat. Oxidarea parțială a metanolului, de exemplu, este dificil de pus în practică, întrucât de obicei reacția duce până la formarea de dioxid de carbon și apă, chiar și în cazul în care se utilizează o cantitate insuficientă de oxigen. Enzima numită metan-monooxigenază ajută la producerea de metanol direct din metan, dar nu poate fi folosită pentru reacții la scară industrială.[9] Metanul are o comportare deosebită față de celelalte hidrocarburi, datorita faptului că legătura covalentă existentă în moleculă este foarte stabilă, iar acest fapt influențează comportamentul său chimic.
Halogenarea
Ca orice hidrocarbură saturată, metanul poate suferi reacții de substituție, reacțiile de halogenare (clorurare) ale metanului fiind cele mai reprezentative din acest punct de vedere. Acestea conduc în final la o compuși mono-, di-, tri- și/sau tetrasubstituți. Halogenarea metanului este o reacție fotochimică, întrucât pentru ca ea să aibă loc este nevoie de intervenția luminii ultraviolete, care interacționează cu halogenul:
- X2 + UV → 2 X•
- X• + CH4 → HX + CH3•
- CH3• + X2 → CH3X + X•
De exemplu, un atom de clor este generat din clorul molecular, diatomic, iar acesta se va lega de un atom de hidrogen din molecula metanului, obținându-se acid clorhidric. Radicalul metil rămas, CH3•, se poate lega de o moleculă de clor, formând monoclorometanul sau clorura de metil (CH3Cl) și un atom de clor. Atomul de clor poate reacționa cu altă moleculă de metan (sau de clorură de metil), continuând astfel reacția de clorinare.[10] În mod similar se pot obține compușii analogi: diclorometan sau clorură de metilen (CH2Cl2), cloroform, triclorometan sau clorură de metin (CHCl3) și în final tetraclorură de carbon (CCl4). Formarea acestor produși de reacție depinde de raportul molar al reactanților:[8]
Combustia și arderea

Prin arderea incompletă a metanului cu cantități insuficiente de aer, în instalații speciale, se obține „negrul de fum”, o sursă importantă pentru sintezele chimice (în special cele pentru fabricarea cauciucului). [8]
Oxidarea și gazul de sinteză
Prin trecerea metanului împreună cu vapori de apă peste catalizatori de aluminiu la o temperatură de circa 850 °C se obține un amestec de oxid de carbon și hidrogen care poate fi folosit drept „gaz de sinteză”:
Acest gaz de sinteză trecut peste un catalizator de fier la 450 °C suferă o transformare la nivelul oxidului de carbon, acesta fiind transformat în dioxid de carbon
Metanul poate suferi și o oxidare catalitică la temperaturi de 600-700 °C, în urma căreia rezultă formaldehida. Atunci când catalizatorii nu sunt prezenți, metanul este stabil până la circa 900 °C. Prin trecerea metanului prin tuburi de cuarț la 1000-1200 °C se formează, cu randamente relativ mici, acetilenă, etenă, butadienă, dar și hidrocarburi aromatice de tipul benzenului, xilenului antracenului, etc. Metanul mai poate suferi și reacții de amonooxidare (tratarea cu amoniac și oxigen, respectiv aer), în urma cărora se formează acid cianhidric (cianurile alcaline, diferite produse intermediare pentru industria materialelor plastice, a fibrelor sintetice, a cauciucului sintetic), sulfura de carbon CS2 (prin tratare cu sulf la 600-700 °C, în prezența catalizatorilor), nitrarea (se obține nitrometan, bun dizolvant).
Obținere

În gazul de iluminat obținut prin distilarea uscată a huilei există un procent de circa 20-30%.
Metode biologice
O mare parte din metanul răspândit în natură a fost produs de către microorganisme prin metanogeneză, o formă de respirație anaerobă. Acest proces biologic, desfășurat în mai multe etape, este folosit de microorganisme ca sursă de energie. Ecuația reacției ce are loc este:
- CO2 + 8 H+ + 8 e− → CH4 + 2 H2O
Astfel, prin fermentația anaerobă metanul este produs prin fermentarea resturilor vegetale sau animale mai ales pe fundul bălților, metoda putând fi folosită și în cazul epurărilor apelor reziduale. Plantațiile de orez produc metan în timpul procesului de creștere a plantei.
Metode industriale
- Metoda Moissan are la bază reacția dintre o carbură (de aluminiu, de beriliu) și apă
Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
- Metoda Dumas folosește ca materie primă acetatul de sodiu (sau de potasiu) prin încălzire cu calce sodată:
CH3-COONa + NaOH → CH4 + Na2CO3
Răspândire
Metanul se găsește sub formă de zăcăminte naturale în stare destul de pură, în România puritatea metanului fiind de 99%, însă se poate întâlni și în minele de cărbuni unde în amestec cu aerul formează amestecul exploziv numit gaz grizu (responsabil de exploziile miniere).
Referințe
- ^ Khalil, M. A. K. (). „Non-Co2 Greenhouse Gases in the Atmosphere”. Annual Review of Energy and the Environment. 24: 645–661. doi:10.1146/annurev.energy.24.1.645.
- ^ „Technical summary”. Climate Change 2001. United Nations Environment Programme. Arhivat din original la . Accesat în .
- ^ Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta ... Sull' Aria Inflammabile Nativa delle Paludi [Letters of Signor Don Alessandro Volta ... on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- ^ „Methane”. BookRags. Accesat în .
- ^ Vezi și:
- A. W. Hofmann (1866) "On the action of trichloride of phosphorus on the salts of the aromatic monamines," Proceedings of the Royal Society of London, 15 : 55-62 ; vezi nota de subsol de la pp. 57-58.
- James Michael McBride (1999) "Development of systematic names for the simple alkanes". Available on-line at: Chemistry Department, Yale University (New Haven, Connecticut). Arhivat în , la Wayback Machine.
- ^ Hensher, David A. & Button, Kenneth J. (). Handbook of transport and the environment. Emerald Group Publishing. p. 168. ISBN 0-08-044103-3.
- ^ Methane Phase change data. NIST Chemistry Webbook.
- ^ a b c „Metanul”, https://www.scribd.com, accesat în Legătură externa în
|newspaper=(ajutor) - ^ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (). „Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase”. Chemical Reviews. 103 (6): 2385–419. doi:10.1021/cr950244f. PMID 12797835.
- ^ March, Jerry (). Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. pp. 533–534.
Vezi și
- Hidrat de metan sau gheața care arde
- Cloroform, un derivat important
- Etan, următorul alcan în seria omoloagă
Legături externe

- en Video despre metan de la The Periodic Table of Videos (Universitatea din Nottingham)
- en Date termodinamice pentru metan
- ro Importanța metanului
| ||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



















