Unbiun
| unbinil ← unbiun → unbibi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
aktyn ↑ Ubu ↓ 121 Ubu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. | unbiun, Ubu, 121 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Unbiun (Ubu, ang. unbiunium) – hipotetyczny pierwiastek chemiczny o liczbie atomowej 121.
Konfiguracja elektronowa
Zakładając, że grupa 3 układu okresowego zawiera skand, itr, lantan i aktyn, unbiun byłby kolejnym pierwiastkiem tej grupy. Prosta ekstrapolacja obliczonych poziomów energetycznych orbitali dla pierwiastków poprzedzających Ubu w grupie wskazywałaby, że jego konfiguracja elektronowa w stanie podstawowym powinna kończyć się obsadzeniem 7d18s2. Ze względu jednak na stabilizację orbitalu 8p w wyniku efektów relatywistycznych korzystniejsza energetycznie jest konfiguracja 8s2p1[4][5], choć różnica w energiach jest bardzo mała[6]. Pomimo że nie zawiera elektronów na orbitalu 5g, zalicza się go do bloku g, którego jest pierwszym elementem, a pierwiastek 138 ostatnim[6][7]. Przewidywanym stopniem utlenienia Ubu w związkach z fluorowcami jest III[6], stabilny powinien być także UbuF (analogicznie do AcF)[2].
Możliwość syntezy
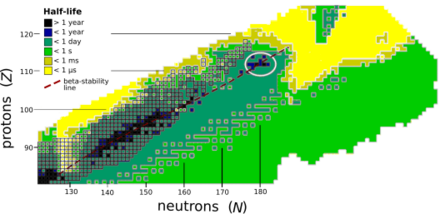
Unbiun jest prawdopodobnie ostatnim pierwiastkiem, który można będzie otrzymać i wykryć metodami opracowanymi dla pierwiastków o liczbie atomowej < 120. Możliwość jego otrzymania jest jednak wątpliwa z powodu niezwykle małego przekroju czynnego przy bombardowaniu dostępnych aktynowców jądrami cięższymi niż 48
Ca oraz przewidywany bardzo krótki czas połowicznego rozpadu, prawdopodobnie krótszy niż kilka mikrosekund koniecznych dla przejścia jądra przez separator[9]. Obliczenia wskazują przy tym, że izotopy 299
Ubu, 300
Ubu i 301
Ubu są najcięższymi jądrami (osiągalnymi obecnie stosowanymi technikami), których czas życia jest dłuższy niż 1 μs[8][9]. Przewiduje się, że trwalsze superciężkie jądra występują w obszarze tzw. wysp stabilności, charakteryzujących się znacznie większą liczbą neutronów, niż w jądrach uzyskiwanych współcześnie. W granicach drugiej wyspy stabilności znajdują się też dłużej żyjące izotopy Ubu[8][9].
Pierwsza próba jego uzyskania podjęta została w 1977 r. w Darmstadt w Niemczech. Izotop 238
U bombardowano jonami miedzi 65
Cu, jednak nie zaobserwowano jąder 121, oczekiwanych w reakcji[10]:
- 238
U + 65
Cu → 303
Ubu*
Przypisy
- ↑ a b Hoffman, Lee i Pershina 2006 ↓, s. 1724.
- ↑ a b Davi H.T.D.H.T. Amador Davi H.T.D.H.T. i inni, 4-Component correlated all-electron study on Eka-actinium Fluoride (E121F) including Gaunt interaction: Accurate analytical form, bonding and influence on rovibrational spectra, „Chemical Physics Letters”, 662, 2016, s. 169–175, DOI: 10.1016/j.cplett.2016.09.025 (ang.).
- ↑ Hoffman, Lee i Pershina 2006 ↓, s. 1659, 1722.
- ↑ Hoffman, Lee i Pershina 2006 ↓, s. 1730–1731.
- ↑ Paul J.P.J. Karol Paul J.P.J., The Periodic Table (continued?): Eka-francium Et Seq., „Chemistry International”, 39 (1), 2017, DOI: 10.1515/ci-2017-0104 (ang.).
- ↑ a b c PekkaP. Pyykkö PekkaP., A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions, „Phys. Chem. Chem. Phys.”, 13 (1), 2011, s. 161–168, DOI: 10.1039/C0CP01575J, PMID: 20967377 (ang.).
- ↑ Jean-PierreJ.P. Dognon Jean-PierreJ.P., PekkaP. Pyykkö PekkaP., Chemistry of the 5g Elements: Relativistic Calculations on Hexafluorides, „Angewandte Chemie”, 129 (34), 2017, s. 10266–10268, DOI: 10.1002/ange.201701609 (ang.).
- ↑ a b c WalerijW. Zagriebajew WalerijW., Opportunities for synthesis of new superheavy nuclei [online], Cyclotron Institute, Texas A&M University, 28 maja 2012 (ang.).
- ↑ a b c d ValeriyV. Zagrebaev ValeriyV., AlexanderA. Karpov AlexanderA., WalterW. Greiner WalterW., Future of superheavy element research: Which nuclei could be synthesized within the next few years?, „Journal of Physics. Conference Series”, 420, 2013, s. 012001, DOI: 10.1088/1742-6596/420/1/012001, arXiv:1207.5700 (ang.).
- ↑ SigurdS. Hofmann SigurdS., On beyond uranium. Journey to the end of the periodic table, London: Taylor & Francis, 2002, s. 105, ISBN 0-415-28496-1, OCLC 49901834 [dostęp 2019-10-31] (ang.).
Bibliografia
- Darleane C.D.C. Hoffman Darleane C.D.C., Diana M.D.M. Lee Diana M.D.M., ValeriaV. Pershina ValeriaV., Transactinides and the future elements, [w:] Lester R.L.R. Morss, Norman M.N.M. Edelstein, JeanJ. Fuger (red.), The Chemistry of the Actinide and Transactinide Elements, wyd. 3, Dordrecht: Springer Science+Business Media, 2006, s. 1652–1752, DOI: 10.1007/1-4020-3598-5, ISBN 1-4020-3555-1 (ang.).
p • d • e Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||









