Pitawastatyna
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||
| Wzór sumaryczny | C25H24FNO4 | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 421,46 g/mol | |||||||||||||||||||||||||||
| Wygląd | biały lub jasnożółty proszek bez zapachu[1] | |||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||
| Numer CAS | 147511-69-1 | |||||||||||||||||||||||||||
| PubChem | 5282452 | |||||||||||||||||||||||||||
| DrugBank | DB08860 | |||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||
| Klasyfikacja medyczna | ||||||||||||||||||||||||||||
| ATC | C10AA08 | |||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Pitawastatyna (łac. pitavastatinum) – wielofunkcyjny organiczny związek chemiczny pochodzenia syntetycznego, mający w swojej cząsteczce wspólną z innymi statynami w formie aktywnej grupę farmakoforową – łańcuch β-hydroksykwasu karboksylowego.
Stosowana jest jako lek zmniejszający stężenie lipidów, ma także dodatkowe działanie plejotropowe na układ krążenia poprzez wpływ na czynność śródbłonka, stabilizację blaszek miażdżycowych, hamowanie układu krzepnięcia, stymulację układu fibrynolizy, hamowanie reakcji zapalnych oraz działanie immunomodulacyjne.
Działa przez hamowanie enzymu reduktazy 3-hydroksy-3-metylo-glutarylokoenzymu A (HMG-CoA).
Znajduje zastosowanie w leczeniu hiperlipidemii, zarówno w monoterapii, jak i leczeniu skojarzonym. Zmniejsza liczbę incydentów wieńcowych, zgonów spowodowanych chorobą wieńcową, udarów mózgu i zabiegów rewaskularyzacyjnych. Jest dobrze tolerowana, a jej najpoważniejszym działaniem niepożądanym jest rabdomioliza.
Występowanie
Pitawastatyna jest syntetycznym związkiem chemicznym i nie występuje naturalnie[9][10].
Historia
W 1973[11] zespół Akira Endō po przebadaniu ponad 6000 szczepów bakteryjnych odkrył, że substancja ML-236B (mewastatyna) wydzielana przez Penicillium citrinum ma właściwości obniżania poziomu cholesterolu oraz lipoproteiny o niskiej gęstości (LDL) w surowicy zwierząt laboratoryjnych i ludzi, jednak badania na zwierzętach wykazały jej potencjalną toksyczność. W 1978 zespół Alfreda Albertsa wyizolował z produktów fermentacji Aspergillus terreus nowy związek o zbliżonej budowie, lowastatynę[12]. W 1986 roku wykazano, że za aktywność biologiczną naturalnych statyn odpowiada łańcuch β-hydroksykwasu karboksylowego, natomiast pierścień naftalenowy może być zastąpiony innym układem pierścieniowym[13]. W latach dziewięćdziesiątych XX wieku w laboratoriach japońskiej firmy farmaceutycznej Nissan Chemical Industries została odkryta siódma statyna – syntetyczna pitawastatyna[14] – która w 2003 wprowadzona została w Japonii, a następnie w 2005 w Korei Południowej i Tajlandii przez Kowa Company[15]. W 2009 pitawastatyna została zarejestrowana przez amerykańską Agencję Żywności i Leków[15].
Kluczowe badania kliniczne
| Akronim badania | Nazwa badania | Czas obserwacji | Wskazania | Miejsce publikacji | Liczba przebadanych pacjentów | Wyniki badania |
|---|---|---|---|---|---|---|
| JAPAN-ACS | Japan Assesment of Pitavastatin and Atorvastatin in Acute Coronary Syndrome | 1 rok |
| Journal of the American College of Cardiology[16] | 252 |
|
| LIVES | LIVALO Effectiveness and Safety (LIVES) Study | 2 lata |
| Japanese Pharmacology and Therapeutics[17] | 20279 |
|
Budowa
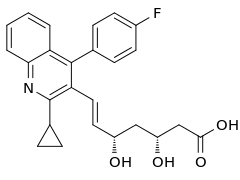
Struktura pitawastatyny opiera się na układzie chinolinowym podstawionym ugrupowaniem p-fluorofenylowym i cyklopropylowym oraz grupą farmakoforową – jednostką β-hydroksykwasu karboksylowego z grupą hydroksylową w położeniu 4[18][3].
Budowa cząsteczki wszystkich statyn nie tylko wykazuje podobieństwo do cząsteczki 3-hydroksy-3-metyloglutarylokoenzymu A, lecz także wykazuje tysiąc razy większe powinowactwo do reduktazy 3-hydroksy-3-metyloglutarylokoenzymu A (HMG-CoA), z którą wiążą się odwracalnie i kompetycyjnie[19].

Mechanizm działania
Proces syntezy cholesterolu przebiega w wielu etapach. Pierwszy z nich to biosynteza mewalonianu. Na początku dzięki tiolazie i syntazie HMG-CoA z reszt acetylowych przenoszonych przez koenzym A powstaje 3-hydroksy-3-metyloglutarylokoenzym A (HMG-CoA). Związek ten jest substratem reduktazy HMG-CoA, która zredukowaną postać fosforanu dinukleotydu nikotynoamidoadeninowego (NADPH+H+) redukuje do mewalonianu (stanowiącego substrat kolejnego etapu syntezy cholesterolu). Aktywność tego enzymu hamują w warunkach naturalnych kwasy żółciowe, cholesterol i sam mewalonian[21]. Jest to kluczowy w tym procesie enzym, którego aktywność ogranicza szybkość biosyntezy cholesterolu[22].


Mechanizm działania statyn[24] opiera się właśnie na specyficznym, kompetytywnym i odwracalnym hamowaniu reduktazy HMG-CoA, co następuje natychmiast po wniknięciu do komórki wątrobowej[25]. Blokowanie syntezy cholesterolu powoduje spadek jego stężenia. Cholesterol uczestniczy w regulacji ekspresji wielu genów poprzez łączenie się z białkami wiążącymi sterolowe elementy regulacyjne, SREBP[24]. Skutkiem tego jest nasilenie transkrypcji genu kodującego receptor dla lipoprotein o niskiej gęstości, wzrost liczby receptorów kodowanych przez ten gen na powierzchni błony komórkowej i zwiększenie wychwytu z krwi lipoprotein niskiej oraz pośredniej gęstości. Biologicznym efektem tego mechanizmu, pod postacią zmian w lipidogramie, jest rozpoczęcie działania statyn po dwóch tygodniach, natomiast pełny efekt występuje po sześciu tygodniach od pierwszej dawki[25].
Zastosowania
Wskazania
Obniżenie podwyższonego stężenia całkowitego cholesterolu (TC) oraz cholesterolu LDL (LDL-C) u pacjentów z pierwotną hipercholesterolemią, łącznie z pacjentami z rodzinną heterozygotyczną hipercholesterolemią oraz współwystępującą (mieszaną) dyslipidemią w sytuacji, gdy stosowana dieta oraz inne metody niefarmakologiczne są niewystarczające[26].
Wytyczne amerykańskie ACC/AHA 2013
American College of Cardiology (ACC) i American Heart Association (AHA) wydały w 2013 roku wytyczne postępowania wpływającego na stężenie cholesterolu we krwi. W dwóch grupach pacjentów zalecono leczenie o umiarkowanej intensywności (docelowe zmniejszenie LDL-C o 30–49%), do którego zaliczono także kurację pitawastatyną w dawce 2–4 mg:
- chorzy z cukrzycą w wieku 40–75 lat ze stężeniem LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) bez dowodów na chorobę sercowo-naczyniową (jeżeli jednak u takiego chorego 10-letnie ryzyko choroby układu krążenia na tle miażdżycy – wyliczone według kalkulatora ryzyka będącego integralną częścią tych wytycznych – jest wyższe niż 7,5%, należy rozważyć leczenie intensywne);
- osoby bez choroby sercowo-naczyniowej i bez cukrzycy, w wieku 40–79 lat, ze stężeniem LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) i 10-letnim ryzykiem choroby sercowo-naczyniowej na tle miażdżycy ≥ 7,5% (wyliczonym według kalkulatora ryzyka będącego integralną częścią tych wytycznych) – należy stosować leczenie umiarkowane lub intensywne[27].
Interakcje
| Stopień ciężki | Stopień duży | Stopień średni | Stopień mały |
|---|---|---|---|
| przeciwwskazania bezwzględne | przeciwwskazania względne | średnie ryzyko ciężkiego zdarzenia niepożądanego | małe ryzyko ciężkiego zdarzenia niepożądanego |
|
|
Dawkowanie
Dawkowanie w różnych sytuacjach klinicznych przedstawia się następująco[29]:
Osoby dorosłe oraz dzieci od 10 roku życia
| Dawka początkowa | Dawka maksymalna | Ocena efektów leczenia i ewentualna korekta dawki |
|---|---|---|
| 1 mg | 4 mg | co cztery tygodnie |
Nie ma konieczności modyfikacji dawki leku u pacjentów w podeszłym wieku.
Dzieci w wieku od 6 do 9 lat
| Dawka początkowa | Dawka maksymalna | Ocena efektów leczenia i ewentualna korekta dawki |
|---|---|---|
| 1 mg | 2 mg | co cztery tygodnie |
Pitawastatyna nie jest przeznaczona do stosowania u dzieci poniżej 6 roku życia.
Zaburzenia czynności nerek
W zaburzenia czynności nerek stężenie cholesterolu frakcji LDL nie jest ani parametrem wskazującym na konieczność leczenia ani celem terapeutycznym[30].
| Wskaźnik filtracji kłębuszkowej [ml/min/1,73 m²] | Dializy | Przeszczepienie nerki | ||
|---|---|---|---|---|
| > 60 | 59–30 | < 30 | ||
| 1–4 | 2 | 2 | 2 | 2 |
Zaburzenia czynności wątroby
| Dawka początkowa | Dawka maksymalna | Ocena efektów leczenia i ewentualna korekta dawki |
|---|---|---|
| 1 mg | 2 mg | co cztery tygodnie |
Ciąża i okres karmienia piersią
Pitawastatyna jest przeciwwskazana w ciąży i w okresie karmienia piersią.
Przedawkowanie
Brakuje specyficznych danych dotyczących postępowania w przedawkowaniu pitawastatyny[26]. Leczenie przedawkowania pitawastatyny jest jedynie objawowe i podtrzymujące. Ze względu na duży stopień wiązania z białkami osocza dializoterapia może okazać się nieskuteczna[26].
Przypisy
- ↑ LIVALO (pitavastatin) Tablet, Film Coated for Oral use [online], U.S. Food and Drug Administration [dostęp 2014-12-06] (ang.).
- ↑ Pitavastatin (calcium salt) [online], Cayman Chemical, numer katalogowy: 15414 [dostęp 2015-03-14] (ang.).
- ↑ a b c d PeterP. Alagona PeterP., Pitavastatin: evidence for its place in treatment of hypercholesterolemia, „Core Evidence”, 5, 2010, s. 91–105, DOI: 10.2147/CE.S8008, PMID: 21468365, PMCID: PMC3065553 (ang.).
- ↑ a b Pitavastatin, [w:] DrugBank, University of Alberta, DB08860 (ang.).
- ↑ Pitavastatin Lactone (CAS 141750-63-2) [online], Santa Cruz Biotechnology [dostęp 2015-03-14] (ang.).
- ↑ Pitavastatin calcium, karta charakterystyki produktu Sigma-Aldrich, Merck, 25 listopada 2022, numer katalogowy: SML2473 [dostęp 2023-09-22] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Pitavastatin Calcium [online], karta charakterystyki produktu Santa Cruz Biotechnology, 20 stycznia 2015, numer katalogowy: SC-208176 [dostęp 2015-03-14] (ang.).
- ↑ a b c Banach, Filipiak i Opolski 2013 ↓, s. 35.
- ↑ VincentV. Gullo VincentV., Arnold L.A.L. Demain Arnold L.A.L., Statins Fermentation Products for Cholesterol Control in Humans, [w:] Chemistry and Pharmacology of Naturally Occurring Bioactive Compounds, GoutamG. Brahmachari (red.), CRC Press, 2013, s. 435–442, ISBN 978-1-4398-9167-4 (ang.).
- ↑ Banach, Filipiak i Opolski 2013 ↓, s. 32.
- ↑ A.A. Endo A.A., The discovery and development of HMG-CoA reductase inhibitors, „Journal of Lipid Research”, 33 (11), 1992, s. 1569–1582, DOI: 10.1016/S0022-2275(20)41379-3, PMID: 1464741 (ang.).
- ↑ Banach, Rysz i Filipiak 2009 ↓, s. 2–3.
- ↑ G.E.G.E. Stokker G.E.G.E. i inni, 3-Hydroxy-3-methylglutaryl-coenzyme A reductase inhibitors. 3. 7-(3,5-Disubstituted [1,1′-biphenyl]-2-yl)-3,5-dihydroxy-6-heptenoic acids and their lactone derivatives, „Journal of Medicinal Chemistry”, 29 (2), 1986, s. 170–181, DOI: 10.1021/jm00152a002, PMID: 3950902 (ang.).
- ↑ R.Y.A.R.Y.A. Mukhtar R.Y.A.R.Y.A., J.J. Reid J.J., J.P.D.J.P.D. Reckless J.P.D.J.P.D., Pitavastatin, „International Journal of Clinical Practice”, 59 (2), 2005, s. 239–252, DOI: 10.1111/j.1742-1241.2005.00461.x, PMID: 15854203 (ang.).
- ↑ a b JunJ. Sasaki JunJ., Pitavastatin approved for treatment of primary hypercholesterolemia and combined dyslipidemia, „Vascular Health and Risk Management”, 6, 2010, s. 997–1005, DOI: 10.2147/VHRM.S7802, PMID: 21127702, PMCID: PMC2988623 (ang.).
- ↑ TakafumiT. Hiro TakafumiT. i inni, Effect of intensive statin therapy on regression of coronary atherosclerosis in patients with acute coronary syndrome: a multicenter randomized trial evaluated by volumetric intravascular ultrasound using pitavastatin versus atorvastatin (JAPAN-ACS [Japan assessment of pitavastatin and atorvastatin in acute coronary syndrome] study), „Journal of the American College of Cardiology”, 54 (4), 2009, s. 293–302, DOI: 10.1016/j.jacc.2009.04.033, PMID: 19608026 (ang.).
- ↑ KuriharaK. Yuji KuriharaK. i inni, A Large-scale, Long-term, Prospective Post-marketing Surveillance of Pitavastatin (LIVALO Tablet) LIVALO Effectiveness and Safety (LIVES) Study, „Japanese Pharmacology and Therapeutics”, 36 (8), 2008, s. 9–40 [zarchiwizowane z adresu 2015-04-12] (ang.).
- ↑ AlfredA. Zejc AlfredA., MariaM. Gorczyca MariaM., Chemia leków, Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 418–421, ISBN 978-83-200-3652-7 .
- ↑ a b DieterD. Steinhilber DieterD., ManfredM. Schubert-Zsilavecz ManfredM., Hermann J.H.J. Roth Hermann J.H.J., Chemia Medyczna, MedPharm Polska, 2012, s. 436, ISBN 978-83-62283-94-1 .
- ↑ Michael B.M.B. Bottorff Michael B.M.B., Safety and Statins: Pharmacologic and Clinical Perspectives [online], 1 listopada 2004 [dostęp 2015-03-22] .
- ↑ KathleenK. Botham KathleenK., Peter A.P.A. Mayes Peter A.P.A., Synteza, transport i wydalanie cholesterolu, [w:] Robert K.R.K. Murray, Daryl K.D.K. Granner, Victor W.V.W. Rodwell, Biochemia Harpera ilustrowana, Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 283, ISBN 978-83-200-3573-5 .
- ↑ WojciechW. Kostowski WojciechW., Leki a lipidy krwi. Farmakoterapia miażdżycy, [w:] Farmakologia. Podstawy farmakoterapii, WojciechW. Kostowski (red.), Zbigniew S.Z.S. Herman (red.), wyd. 3, t. I, Warszawa: Wydawnictwo Lekarskie PZWL, 2003, s. 220, ISBN 83-200-3351-9 .
- ↑ AkiraA. Endo AkiraA., A historical perspective on the discovery of statins, „Proceedings of the Japan Academy. Series B, Physical and Biological Sciences”, 86 (5), 2010, s. 484–493, DOI: 10.2183/pjab.86.484, PMID: 20467214, PMCID: PMC3108295 (ang.).
- ↑ a b ErnstE. Mutschler ErnstE. i inni, Farmakologia i toksykologia, Wrocław: MedPharm polska, 2010, s. 554–561, ISBN 978-83-60466-81-0 .
- ↑ a b MaciejM. Banach MaciejM., JacekJ. Rysz JacekJ., Krzysztof J.K.J. Filipiak Krzysztof J.K.J., Simwastatyna, Gdańsk: Via Medica, 2009, s. 5–6, ISBN 978-83-7599-118-5 .
- ↑ a b c Charakterystyka Produktu Leczniczego Vezepra [online], Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [zarchiwizowane z adresu 2016-03-15] .
- ↑ BarbaraB. Cybulska BarbaraB., LonginaL. Kłosiewicz-Latoszek LonginaL., Podejście do leczenia hipolipemizującego w świetle aktualnych wytycznych amerykańskich i europejskich, „Medycyna Praktyczna”, 275 (1), 2014, s. 18–22 [dostęp 2015-03-14] .
- ↑ Kenneth A.K.A. Kellick Kenneth A.K.A., MichaelM. Bottorff MichaelM., Peter P.P.P. Toth Peter P.P.P., A clinician’s guide to statin drug-drug interactions, „Journal of Clinical Lipidology”, 8 (3 Suppl), 2014, S30–46, DOI: 10.1016/j.jacl.2014.02.010, PMID: 24793440 (ang.).
- ↑ Pitamet (pitawastatyna) – tabletki powlekane [online], Medycyna Praktyczna .
- ↑ Chapter 2: Pharmacological cholesterol-lowering treatment in adults, „Kidney International Supplements”, 3 (3), 2013, s. 271–279, DOI: 10.1038/kisup.2013.34, PMID: 25019001, PMCID: PMC4089587 (ang.).
- ↑ KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease, „Kidney international Supplements”, 3 (3), 2013, s. 274 [zarchiwizowane z adresu 2014-12-30] (ang.).
Bibliografia
- MaciejM. Banach MaciejM., Krzysztof J.K.J. Filipiak Krzysztof J.K.J., GrzegorzG. Opolski GrzegorzG., Aktualny stan wiedzy na temat statyn, Poznań 2013, ISBN 978-83-63622-21-3 .
 Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
- p
- d
- e
- p
- d
- e
| C10A – Leki zmniejszające stężenie lipidów we krwi |
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| C10B – Leki zmniejszające stężenie lipidów w połączeniach |
|