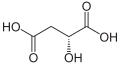
Kwas jabłkowy
| |||||||||||||||||||||||||
 krystaliczny kwas DL-jabłkowy (racemat) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | C4H6O5 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | C2H3OH(COOH)2 | ||||||||||||||||||||||||
| Masa molowa | 134,09 g/mol | ||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 6915-15-7 | ||||||||||||||||||||||||
| PubChem | 525 | ||||||||||||||||||||||||
| DrugBank | DB12751 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | kwas bursztynowy | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Kwas jabłkowy (kwas hydroksybursztynowy, łac. Acidum malicum, E296) – organiczny związek chemiczny, α-hydroksykwas dikarboksylowy występujący m.in. w jabłkach i rabarbarze[2]. Jest produktem ubocznym metabolizmu węglowodanów. Jego forma zjonizowana (jabłczan) występuje jako produkt pośredni w cyklu kwasu cytrynowego (cyklu Krebsa).
Zawiera jedno centrum stereogeniczne i jego cząsteczka jest chiralna. Naturalnie występuje enancjomer o konfiguracji L (konfiguracja absolutna S), wykazujący skręcalność właściwą [α]20D = −2,9°. Syntetyczny kwas jabłkowy jest racematem[3].
Podczas ogrzewania bez dostępu powietrza ulega dehydratacji do mieszaniny kwasu fumarowego i kwasu maleinowego[4]
Stosuje się go w przemyśle spożywczym jako konserwant oraz w przemyśle farmaceutycznym[2].
Przypisy
- ↑ a b c d e Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6 .
- ↑ a b c d Podręczny słownik chemiczny, RomualdR. Hassa (red.), JanuszJ. Mrzigod (red.), JanuszJ. Nowakowski (red.), Katowice: Videograf II, 2004, s. 212, ISBN 83-7183-240-0 .
- ↑ a b jabłkowy kwas, [w:] Encyklopedia techniki. Chemia, WładysławW. Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 297, OCLC 33835352 .
- ↑ Goldberg, Israel, Rokem, J Stefan, Pines, Ophry. Organic acids: old metabolites, new themes. „Journal of Chemical Technology & Biotechnology”. 81 (10), s. 1601-1611, 2006. DOI: 10.1002/jctb.1590.
- p
- d
- e
- Britannica: science/malic-acid
- SNL: eplesyre
- Catalana: 0121239
- DSDE: æblesyre