Nadtlenek wodoru
| |||||||||||||||||||||||||||
 Próbka 30% perhydrolu | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | H2O2 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HO−OH, H−O−O−H | ||||||||||||||||||||||||||
| Masa molowa | 34,01 g/mol | ||||||||||||||||||||||||||
| Wygląd | bezbarwna, syropowata ciecz[1] | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | 7722-84-1 | ||||||||||||||||||||||||||
| PubChem | 784 | ||||||||||||||||||||||||||
| DrugBank | DB11091 | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | woda, hydrazyna, difluorek tlenu | ||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Nadtlenek wodoru, H
2O
2 – nieorganiczny związek chemiczny z grupy nadtlenków, jedna z reaktywnych form tlenu[4]. Otrzymany został po raz pierwszy przez Louisa Thénarda w 1818 roku w reakcji nadtlenku baru z kwasem azotowym[5].
Budowa cząsteczki
Układ wiązań O−O−H wokół atomów tlenu w cząsteczce H
2O
2 jest nieliniowy (podobnie jak układ H−O−H w wodzie), ponadto atomy H−O−O−H tworzą kąt dwuścienny (w fazie stałej około 90°).
- Budowa cząsteczki nadtlenku wodoru
-
 w stanie stałym
w stanie stałym -
 w stanie gazowym
w stanie gazowym
Otrzymywanie
Pierwszą i obecnie już tylko historyczną metodą otrzymywania nadtlenku wodoru na skalę przemysłową był proces Thénarda[6][7]:
- BaO
2 + H
2SO
4 → BaSO
4 + H
2O
2
Obecnie otrzymuje się go najczęściej tzw. metodą antrachinonową przez utlenianie 2-etylo-9,10-antracenodiolu gazowym tlenem przepuszczanym przez roztwór tego związku w mieszaninie odpowiednio dobranych rozpuszczalników[6][7]. Nadtlenek oddziela się poprzez ekstrakcję z wodą, zaś pozostały w roztworze 2-etyloantrachinon poddaje się regeneracji poprzez redukcję gazowym wodorem do 2-etylo-9,10-antracenodiolu, katalizowaną palladem osadzonym na odpowiednim nośniku lub związkami niklu. W przemysłowych metodach produkcji cykl obu reakcji (utleniania i redukcji) prowadzi się naprzemiennie.

Rozcieńczony roztwór wodny nadtlenku otrzymany w tym procesie zatęża się przez ostrożne odparowywanie wody pod zmniejszonym ciśnieniem, uzyskując w ten sposób roztwór o stężeniu maksymalnie 70%. Dalsze zatężanie prowadzi do wybuchu. Bardziej stężone roztwory oraz całkowicie czysty nadtlenek uzyskuje się prawdopodobnie przez wymrażanie go z wodnego, stężonego roztworu[8].
W Polsce jedynym producentem nadtlenku wodoru są należące do Grupy Azoty Zakłady Azotowe „Puławy” SA Funkcjonująca od 1995 roku instalacja zapewnia produkcję na poziomie 10 tysięcy ton rocznie. W roku 1997 dobudowano instalację do oczyszczania oraz zatężania nadtlenku wodoru wg technologii szwajcarskiej firmy Sulzer Chemtech, poszerzając tym samym ofertę o nowe stężenia nadtlenku wodoru. Od 2015 roku stabilizowane roztwory wodne nadtlenku wodoru wytwarzane w puławskich zakładach są dopuszczone do sprzedaży na rynkach UE w stężeniach 35%, 49,5%, 50% i 60%, zgodnie z obowiązującymi przepisami. Produkt jest eksportowany na rynki zagraniczne do krajów takich jak Litwa, Łotwa, Słowacja czy Węgry[9].
Inną, rzadziej stosowaną metodą, jest utlenianie izopropanolu:
- (CH
3)
2CHOH + O
2 → (CH
3)
2C=O + H
2O
2
Reakcja ma przebieg wolnorodnikowy i nie wymaga dodatkowych katalizatorów, gdyż jest katalizowana przez H
2O
2 (do substratu dodaje się niewielką jego ilość aby przyspieszyć fazę początkową). Jej drugim produktem przemysłowym jest aceton. Metoda ta stosowana była w drugiej połowie XX w.; w pierwszej dekadzie XXI w. działały już tylko dwie instalacje w byłym ZSRR. Takiej samej reakcji ulegają inne alkohole, jednak w przypadku alkoholi pierwszorzędowych powstające aldehydy ulegają utlenianiu przez H
2O
2 do kwasów karboksylowych, co wyklucza ich wykorzystanie w tym procesie[7].
Nadtlenek wodoru można też otrzymywać metodą elektrolityczną z H
2SO
4 lub NH
4HSO
4[7]:
- 2H
2SO
4 → H
2S
2O
8 + H
2↑ - 2NH
4HSO
4 → (NH
4)
2S
2O
8 + H
2↑
W obu przypadkach H
2O
2 uzyskuje się następnie przez hydrolizę[7]:
- S
2O2−
8 + 2H
2O → 2HSO−
4 + H
2O
2
Właściwości
Nadtlenek wodoru w temperaturze pokojowej jest syropowatą, bezbarwną (stężony staje się bladoniebieski) cieczą o temperaturze topnienia −0,44 °C i temperaturze wrzenia około 150 °C. Ma silne właściwości utleniające, wynikające z powstawania w czasie jego rozkładu tlenu atomowego (tak zwany tlen in statu nascendi[10]):
- H
2O
2 → H
2O + O
Czysty nadtlenek wodoru jest nietrwały – ulega egzotermicznemu rozkładowi (często wybuchowemu), na wodę i tlen, pod wpływem ciepła, światła nadfioletowego oraz kontaktu z niektórymi metalami (na przykład manganem) i tlenkami metali.
- 2H
2O
2
(aq) → 2H
2O
(l) + O
2
(g)
Rozkład ten jest katalizowany przez wiele rozdrobnionych substancji, na przykład srebro, platynę i tlenek manganu(IV)[6].
Jej rozkład katalizują też jodki[11], przy czym H
2O
2 utlenia I−
do I
2[12][13], a reakcja H
2O
2 z jodem (lub jodanami) ma charakter reakcji oscylacyjnej[14]:
- 5H
2O
2 + I
2 → 2HIO
3 + 4H
2O - 5H
2O
2 + 2HIO
3 → I
2 + 6H
2O + 5O
2↑
Wydajnym enzymem rozkładającym nadtlenek wodoru jest katalaza.
Ze względu na to, że łatwo reaguje on z wieloma metalami, a także ulega rozkładowi w kontakcie ze szkłem, należy go przechowywać w ciśnieniowych butelkach z grubościennego polietylenu lub aluminium i nie wystawiać na działanie światła dziennego oraz źródeł ciepła. Jego kompleks z węglanem sodu typu hydratu (Na
2CO
3·1,5H
2O
2, tak zwany nadwęglan sodu) jest natomiast względnie trwały i bezpieczny w użyciu[15].
Nadtlenek wodoru wykazuje słabe właściwości kwasowe. W roztworach wodnych ulega on dysocjacji według równania[16]:
- H
2O
2 + H
2O → H
3O+
+ H−O−O−
(K = 0,5×10−12)
Właściwości utleniająco/redukujące
Wobec reduktorów nadtlenek wodoru zachowuje się jak utleniacz (O-I
→ O-II
), na przykład[16]:
- NH
2OH + 3H
2O
2 → HNO
3 + 4H
2O
Wobec utleniaczy wykazuje właściwości redukujące (O-I
→ O0
), między innymi w reakcji z nadmanganianem potasu w środowisku kwaśnym[16]:
- 2KMnO
4 + 5H
2O
2 + 3H
2SO
4 → 2MnSO
4 + 5O
2 + K
2SO
4 + 8H
2O
lub z solami srebra(I) w środowisku zasadowym[16]:
- 2AgNO
3 + H
2O
2 + 2KOH → 2Ag + O
2 + 2H
2O + 2KNO
3
Właściwości biologiczne
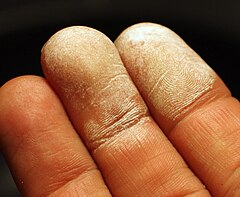

Jest to substancja żrąca wobec żywych tkanek[1]. Przy kontakcie ze skórą pojawiają się białe martwicze plamy.
Zastosowanie
Czysty nadtlenek wodoru jest niedostępny handlowo, gdyż prawo większości krajów Europy oraz Stanów Zjednoczonych zabrania jego sprzedaży ze względów bezpieczeństwa. W handlu dostępne są maksymalnie 70% roztwory tego związku, i to po spełnieniu specjalnych warunków (przepisy RID i ADR)[potrzebny przypis]. Najczęstszą postacią handlową jest tak zwany perhydrol, czyli jego 30% roztwór wodny, oraz roztwór 3%, nazywany wodą utlenioną[10].
Woda utleniona (roztwór 3%)
 | Zobacz hasło woda utleniona w Wikisłowniku |
Jest stosowana do odkażania powierzchownych ran, a po rozcieńczeniu wodą, w stosunku około 1:50, do płukania jamy ustnej w stanach zapalnych[17][18]. Takie roztwory do bezpośredniego użycia dostępne są w aptekach. Woda utleniona jest też składnikiem preparatów złożonych o podobnym przeznaczeniu, na przykład płukanki Parmy.
Woda utleniona rozkłada się przy kontakcie z krwią i peroksydazami, gwałtownie wydzielając tlen i spieniając okolice zranienia. Powszechnie uważa się, że pozwala to na wyczyszczenie i oddzielenie zabrudzeń oraz bakterii z zakamarków tkanek otaczających zranienie[1], jednak pogląd ten nie ma większego oparcia w faktach[19], a samo stosowanie wody utlenionej do odkażania ran ma wady[19]. Woda utleniona ma naturalne właściwości hemolityczne, a ponadto może prowadzić do oddzielania się świeżego nabłonka od ziarniny w miejscu zranienia[19]. Właściwości bakteriobójcze wody utlenionej przy opatrywaniu zranień są słabe i krótkotrwałe[19], a stosowanie jej nie zmniejsza ryzyka zakażenia[20][21], a w pewnych przypadkach może opóźnić gojenie się zranień[22][23]. Według innego opracowania woda utleniona nie ma znaczącego negatywnego wpływu na gojenie się ran – ale także nie obniża ryzyka zakażenia (głównie z powodu obniżonej aktywności w rozcieńczonych roztworach, osłabianej dodatkowo przez katalazy bakteryjne i z otaczających zranienie tkanek)[20]. Z tego powodu woda utleniona może co najwyżej wspomagać opatrywanie zranień obficie pokrytych zaschniętą lub zakrzepłą krwią, w czym pomagać mają jej właściwości hemolityczne[19].
Roztwory wody utlenionej są zalecane w pseudonaukowej metodzie leczącej jakoby niektóre rodzaje nowotworów, a także inne schorzenia, poprzez wywoływanie tak zwanej hiperoksygenacji. W oparciu o badania naukowe, American Cancer Society całkowicie neguje skuteczność takich terapii i odradza je jako alternatywę dla ustalonych medycznych procedur leczenia nowotworów[24].
Wybielacz (roztwory 3–15%)
Roztwory 3–15% są zwykle stosowane jako wybielacz na bazie aktywnego tlenu w środkach chemii gospodarczej, roztwory 3–12% są stosowane we fryzjerstwie do farbowania i rozjaśniania włosów.
Perhydrol (roztwory 30–35%)
 Osobny artykuł: Perhydrol.
Osobny artykuł: Perhydrol.
Perhydrol stosuje się jako silny środek utleniający w przemyśle chemicznym, na przykład do produkcji barwników organicznych, a także inicjatorów nadtlenkowych (w tym heksametylenotriperoksydiaminy oraz trimerycznego i tetramerycznego nadtlenku acetonu).
Utleniacz paliwa (roztwory 85–98%)
Nadtlenek wodoru o stężeniu 85–98% stosowany jest jako utleniacz paliwa rakietowego oraz paliwa do okrętów podwodnych[25]. Roztwór 60% był używany już podczas II wojny światowej przez Niemców w rakietach V2[1] i samolotach Messerschmitt Me 163 (pod kryptonimem T-Stoff i innymi) oraz okrętach podwodnych i torpedach (pod kryptonimem Ingolin, Aurol i innymi). Nadtlenek wodoru był wykorzystywany w silnikach rakietowych na satelitach serii Syncom[26]. Obecnie jest stosowany jako utleniacz na rakietach suborbitalnych ILR-33 BURSZTYN[27] oraz Nucleus[28].
Wyciek wysoko skoncentrowanego do wartości między 85% a 98% nadtlenku wodoru (noszącego w takim stężeniu angielską nazwę high test peroxide – HTP), używanego jako utleniacz dla paliwa w przenoszonych przez okręt podwodny „Kursk” ciężkich torpedach przeciwokrętowych 65-76 Kit był w 2000 roku przyczyną wybuchu na tym okręcie, który następnie zatonął wraz z całą 118-osobową załogą[29].
Zobacz też
Przypisy
- ↑ a b c d e Podręczny słownik chemiczny, RomualdR. Hassa (red.), JanuszJ. Mrzigod (red.), JanuszJ. Nowakowski (red.), Katowice: Videograf II, 2004, s. 259–260, ISBN 83-7183-240-0 .
- ↑ MałgorzataM. Galus MałgorzataM., Tablice chemiczne, Warszawa: Wydawnictwo Adamantan, 2008, s. 171–170, ISBN 978-83-7350-105-8 .
- ↑ a b c d e Hydrogen peroxide 60% or more, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 002430 [dostęp 2022-02-06] (niem. • ang.).
- ↑ Nadtlenek wodoru, [w:] GrzegorzG. Bartosz GrzegorzG., Druga twarz tlenu, wyd. 2, Warszawa: Wydawnictwo Naukowe PWN, 2008 (Środowisko), s. 28, 46, ISBN 978-83-01-13847-9 .
- ↑ Louise JacquesL.J. Thénard Louise JacquesL.J., Observations sur des Combinaisons nouvelles entre l’oxigène et divers acides, „Annales de chimie et de physique”, 8, 1818, s. 306–313 (fr.).
- ↑ a b c AdamA. Bielański AdamA., Podstawy chemii nieorganicznej, wyd. 5, Warszawa: PWN, 2002, s. 606–607, ISBN 83-01-13654-5 .
- ↑ a b c d e GustaafG. Goor GustaafG., JürgenJ. Glenneberg JürgenJ., SylviaS. Jacobi SylviaS., Hydrogen Peroxide, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2007, DOI: 10.1002/14356007.a13_443.pub2 (ang.).
- ↑ Zatężanie do 100%, patrz: JulianJ. Gałecki JulianJ., Preparatyka nieorganiczna. Czyste odczynniki chemiczne, Warszawa: Wydawnictwa Naukowo-Techniczne, 1964, s. 903–904 .
- ↑ MagdalenaM. Korol MagdalenaM., ElżbietaE. Sikora ElżbietaE., Preparaty do mycia o działaniu przeciwdrobnoustrojowym na bazie nadtlenku wodoru, „Przemysł Chemiczny”, 101 (9), SIGMA-NOT, 2022, s. 670, DOI: 10.15199/62.2022.9.6, ISSN 0033-2496 [dostęp 2022-12-06] .
- ↑ a b nadtlenek wodoru, [w:] Encyklopedia techniki. Chemia, WładysławW. Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 449, OCLC 33835352 .
- ↑ Robert G.R.G. Mortimer Robert G.R.G., Physical Chemistry, wyd. 3, Elsevier, 2008, s. 506, ISBN 978-0-12-370617-1 (ang.).
- ↑ GeoffG. Rayner-Canham GeoffG., TinaT. Overton TinaT., Descriptive Inorganic Chemistry, W.H. Freeman and Company, 2010, s. 424, ISBN 978-1-4292-2434-5 (ang.).
- ↑ C.C. Chambers C.C., A.K.A.K. Holliday A.K.A.K., Modern Inorganic Chemistry, Butterworths, 1975, s. 280 (ang.).
- ↑ Norman N.N.N. Greenwood Norman N.N.N., AlanA. Earnshaw AlanA., Chemistry of the Elements, wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, s. 865, ISBN 0-7506-3365-4 (ang.).
- ↑ R.G.R.G. Pritchard R.G.R.G., E.E. Islam E.E., Sodium percarbonate between 293 and 100 K, „Acta Crystallographica”, B59, 2003, s. 596–605, DOI: 10.1107/S0108768103012291 .
- ↑ a b c d Philip JohnP.J. Durrant Philip JohnP.J., BrylB. Durrant BrylB., Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965, s. 914–917 .
- ↑ Woda utleniona 3% – opis produktu [online], Supple.pl [dostęp 2014-12-26] .
- ↑ Woda utleniona 3% – opis produktu [online], Doz.pl [dostęp 2011-06-08] .
- ↑ a b c d e 7. Wound cleansing and irrigation, [w:] AlexanderA. Trott AlexanderA., Wounds and lacerations: emergency care and closure, Philadelphia: Elsevier Health Sciences, 2005, s. 85, ISBN 978-0-323-02307-8 (ang.).
- ↑ a b A.A. Drosou A.A., A.A. Falabella A.A., R.S.R.S. Kirsner R.S.R.S., Antiseptics on wounds: An area of controversy, „Wounds”, 15 (5), 2003, s. 149–166 [dostęp 2011-02-02] [zarchiwizowane z adresu 2015-07-08] (ang.).
- ↑ W.Y.W.Y. Lau W.Y.W.Y., S.H.S.H. Wong S.H.S.H., Randomized, prospective trial of topical hydrogen peroxide in appendectomy wound infection. High risk factors, „Am J Surg”, 142 (3), 1981, s. 393–397, DOI: 10.1016/0002-9610(81)90358-5, PMID: 7283035 (ang.).
- ↑ G.W.G.W. Thomas G.W.G.W. i inni, Mechanisms of delayed wound healing by commonly used antiseptics, „J Trauma”, 66 (1), 2009, s. 82–91, DOI: 10.1097/TA.0b013e31818b146d, PMID: 19131809 (ang.).
- ↑ R.P.R.P. Gruber R.P.R.P., L.L. Vistnes L.L., R.R. Pardoe R.R., The effect of commonly used antiseptics on wound healing, „Plast Reconstr Surg”, 55 (4), 1975, s. 472–476, PMID: 1090959 (ang.).
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies, „CA Cancer J Clin”, 43 (1), s. 47–56, DOI: 10.3322/canjclin.43.1.47, PMID: 8422605 (ang.).
- ↑ U-Boot Typ XVII (Versuchsboote), [w:] Lexikon der Wehrmacht [online] (niem.).
- ↑ Syncom 1, [w:] NASA Space Science Data Coordinated Archive [online] [dostęp 2022-02-06] (ang.).
- ↑ DawidD. Cieśliński DawidD., TomaszT. Noga TomaszT., ArthurA. Pazik ArthurA., Polish civil rockets’ development overview, „Obronność RP XXI wieku w teorii i praktyce”, 2021 .
- ↑ Nucleus: A Very Different Way to Launch into Space [online], Nammo [dostęp 2022-02-06] (ang.).
- ↑ Martin Bright: What really happened to Russia's 'unsinkable' sub. The Guardian, 2001-8-05. [dostęp 2023-04-15]. [zarchiwizowane z tego adresu (2023-02-09)]. (ang.).
 Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
- p
- d
- e
- p
- d
- e
| A01AA – Preparaty zapobiegające próchnicy |
|
|---|---|
| A01AB – Leki przeciwinfekcyjne i odkażające do stosowania miejscowego w jamie ustnej |
|
| A01AC – Kortykosteroidy do miejscowego stosowania w jamie ustnej | |
| A01AD – Inne leki do miejscowego stosowania w jamie ustnej |
- p
- d
- e
| D08A – Środki antyseptyczne i dezynfekujące |
|
|---|
- p
- d
- e
| D11A – Inne preparaty dermatologiczne |
|
|---|
- p
- d
- e
| S02A – Leki przeciwinfekcyjne |
| ||
|---|---|---|---|
| S02B – Kortykosteroidy |
| ||
| S02C – Połączenia kortykosteroidów i leków przeciwinfekcyjnych |
| ||
| S02D – Inne leki otologiczne |
|
- p
- d
- e
| Kwasy beztlenowe i ich analogi |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kwasy tlenowe |
|
- Kategoria:Kwasy nieorganiczne
- Britannica: science/hydrogen-peroxide
- Treccani: acqua-ossigenata
- БРЭ: 1922229
- SNL: hydrogenperoksid
- DSDE: brintoverilte













