Kwas askorbinowy
| |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C6H8O6 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 176,13 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek lub bezbarwne kryształy, ciemniejące na świetle i powietrzu[1] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | 50-81-7 | ||||||||||||||||||||||||||||||||
| PubChem | 54670067 | ||||||||||||||||||||||||||||||||
| DrugBank | DB00126 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Pochodne sole | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||
| ATC | G01 AD03 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||

Kwas askorbinowy, witamina C, E300 (łac. acidum ascorbicum) – organiczny związek chemiczny z grupy nienasyconych alkoholi polihydroksylowych. Jest niezbędny do funkcjonowania organizmów żywych. Dla niektórych zwierząt oraz ludzi jest witaminą, czyli musi być dostarczany w pożywieniu. Jest także przeciwutleniaczem stosowanym jako dodatek do żywności[7].
Budowa i właściwości chemiczne
Występuje naturalnie jako związek o konfiguracji L w łańcuchu bocznym i konfiguracji D układu furanowego. Pod wpływem metanolowego roztworu NaOH ulega epimeryzacji do kwasu erytrobowego (kwasu D-izoaskorbinowego, E315), różniącego się konfiguracją łańcucha bocznego[8].
Kwas L-askorbinowy bywa niepoprawnie nazywany „lewoskrętną witaminą C” ze względu na mylenie konfiguracji względnej z aktywnością optyczną[9][10]. W rzeczywistości kwas L-askorbinowy skręca płaszczyznę światła spolaryzowanego w prawą stronę ([α]20D ≃ +20°). Natomiast kwas D-askorbinowy jest przeciwutleniaczem, ale oprócz tego nie ma znaczenia biologicznego – nie działa jako kofaktor, więc nie jest witaminą[11][10][12].
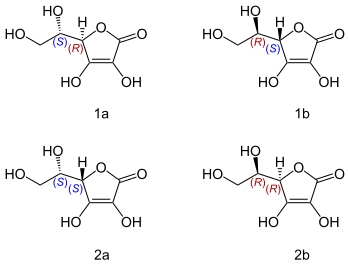
kwas L-askorbinowy (R,S) (1a), kwas D-askorbinowy (S,R) (1b)
kwas L-izoaskorbinowy (S,S) (2a), kwas D-izoaskorbinowy (R,R) (2b)
Charakter kwasowy mają grupy hydroksylowe w pozycjach 3 i 4, zwłaszcza grupa 4-OH, której pKa wynosi 4,17[8]. Anion powstały po dysocjacji protonu z grupy 4-OH jest stabilizowany przez rezonans chemiczny:

Jest bardzo nietrwała, łatwo ulega rozpadowi pod wpływem tlenu i wysokiej temperatury[13].
Występowanie i synteza
Biosynteza
Kwas L-askorbinowy występuje naturalnie w wielu organizmach roślinnych i zwierzęcych[7]. W obu królestwach substratem do biosyntezy tego związku jest D-glukoza, jednak przebiega ona w różny sposób. U roślin glukoza jest utleniana w pozycji C-2, po czym następuje epimeryzacja atomu C-5 i kolejne utlenianie, w pozycji C-1. U zwierząt szlak metaboliczny przebiega przez kwas glukuronowy, po czym następuje inwersja szkieletu węglowego, w efekcie czego atomy C-1 i C-6 glukozy stają się odpowiednio atomami C-6 i C-1 kwasu askorbinowego[8].
Niezdolność do syntezy
U szeregu zwierząt, między innymi naczelnych, a także odległych gatunkowo świnek morskich[7][14][15] lub ryb doskonałokostnych (należą do nich pstrąg tęczowy i karp), kwas askorbinowy musi być dostarczany w pożywieniu, gdyż ich organizmy go nie wytwarzają. U naczelnych jest to efektem mutacji w genie odpowiedzialnym za wytwarzanie oksydazy L-gulono-γ-laktonowej (GLO), która w wątrobie katalizuje ostatni etap biosyntezy kwasu askorbinowego z D-glukozy, tj. utleniania L-gulonolaktonu[14][15]. Szacuje się, że unieczynnienie tego genu nastąpiło około 60–75 mln lat temu, wkrótce po rozdzieleniu się małp właściwych i małpiatek[15]. Natomiast u ryb doskonałokostnych oprócz mutacji w GLO obecne są też inne mutacje uniemożliwiające syntezę witaminy C; niezdolność do wytwarzania tego związku pojawiła się u nich ok. 200 mln lat temu[15][16][17].
Produkcja
Większość kwasu askorbinowego produkowanego przemysłowo jest wytwarzana metodą opracowaną w 1934 przez Reichsteina i Grüssnera[18], w której substratem jest także naturalna D-glukoza[8].
Źródła w pożywieniu

Witamina C zawarta w pożywieniu należy do najbardziej wrażliwych na działanie czynników zewnętrznych witamin, niszczy ją (utlenianie) wysoka temperatura, wystawienie na dostęp światła oraz na bezpośredni kontakt z powietrzem[19].
| Produkt | Zawartość (mg/100 g) |
|---|---|
| Wątroba wołowa | 30[a] |
| Wątroba wieprzowa | 22[a] |
| Dorsz | 2[a] |
| Pstrąg | 1[a] |
| Mleko krowie | 1[a] |
Rola w organizmie człowieka
Jest przeciwutleniaczem[29][30]. Aktywuje wiele enzymów[7], wpływa na syntezę kortykosteroidów[29][30] oraz niektórych neuroprzekaźników[30]. Utrzymuje prawidłowy stan tkanki łącznej[29][31] (jest niezbędny w biosyntezie kolagenu[13][30][32][31]), wzmacnia dziąsła i zęby, zabija bakterie wywołujące próchnicę zębów[32]. Wzmacnia odporność organizmu na infekcje[13][30][32][31]. Ułatwia gojenie się ran[31]. Stabilizuje psychikę[32]. Bierze udział w rozkładzie tyrozyny, w syntezie kwasów żółciowych z cholesterolu, oraz w syntezie karnityny[33]. W komórkach watroby nasila syntezę cytochromu P450 niezbędengo do unieszkodliwania toksyn[33]. Ma również wpływ na zachowanie prawidłowego potencjału oksydacyjnego w komórce[potrzebny przypis]. Od dawna znane jest zwiekszenie wchłaniania żelaza[13][29][32] i hamowanie tworzenia nitrozoamin z azotanów i amin w żołądku[33].
Badania wskazują brak wpływu zażywania witaminy C na ryzyko pojawienia się przeziębienia oraz mały wpływ na czas jego trwania (skrócenie czasu o 14% dla dzieci i 8% dla dorosłych). Wyjątkiem była grupa uczestników maratonów, narciarzy i żołnierzy przebywających w bardzo niskich temperaturach lub poddanych intensywnemu wysiłkowi fizycznemu, u których zaobserwowano 50% zmniejszenie występowania przeziębienia przy zażywaniu 2 g witaminy C dziennie[34].
W celu utrzymania jej maksymalnego stęzenia w osoczu i tkankach wymgane jest przyjęcie od 100 do 200 mg na dobę[33], żeby uniknąc objawów wystarczy także 75 mg/dzień[35][36]. Zwiększone zapotrzebiwanie na witamine C jest w ciąży i laktacji, w czasie antybiotykoterapii, hemodializy[33]. Obserwuje się zbyt małą podaż witaminy C u seniorów[33]. Organizmy większości zwierząt i roślin wytwarzają ten związek. Wyjątkiem są małpy człekokształtne (w tym człowiek), świnki morskie i niektórych gatunków nietoperzy (ze względu na mutację i utratę enzymu: oksydazy L-gulonolaktonowej), którym musi być ona dostarczona z zewnątrz[37].
| Zalecane dzienne spożycie wit. C mg/dzień[33] | |
|---|---|
| 150 | kobiety karmiące |
| 150 | palacze |
| 100 | >13 lat |
| 90 | 10-12 lat |
| 80 | 7-9 lat |
| 70 | 4-6 lat |
| 60 | 1-3 lat |
Skutki niedoboru
Szkorbut[7][13][29][30][32][31] (krwawienie i owrzodzenie dziąseł, wypadanie zębów)[29][31], kruchość i pękanie naczyń krwionośnych[29][30][32], osłabienie odporności organizmu[29][32][31], obrzmiałe i bolesne stawy[29], nieprawidłowe zrastanie się kości, powolne gojenie się ran[30][31].
Zachodnie społeczeństwa przeważnie spożywają więcej witaminy C w diecie, niż jest niezbędne do wystapienia klinicznych objawów szkorbutu[38].
Na jej niedobór cierpią palacze tytoniu, dlatego w wielu krajch normy spożycia dla osób palących zostały podwyższone[33].
Skutki nadmiaru
Dla witaminy C nie są znane objawy hiperwitaminozy: nie obserwowano skutków ubocznych przyjmowania dawek sięgających 10g/dzień[33]. Nadmiar wydalany jest z organizmu przez nerki, jednak w przypadku przyjęcia jednorazowo megadawki (>3 g) większe ilości wydalane są z kałem[33].
Suplementacja
Badania naukowe nad potencjalnymi pozytywnymi skutkami zdrowotnymi suplementacji witaminą C dostarczają sprzecznych wyników. Badanie przeprowadzone przez U.S. Preventive Disease Task Force nie wykazało dowodów na ochronny wpływ suplementacji witaminą C przeciwko rozwojowi chorób układu krążenia i nowotworów[39]. Nie udało się także klinicznie udowodnić wpływu witaminy C na długość życia[40].
Zapobieganie rozwojowi nowotworów
W 2 badaniach z 2009 roku nie stwierdzono wpływu spożywania witaminy C na ryzyko rozwoju raka płuc i na śmiertelność w tej chorobie[41]. Metaanaliza z roku 2014 wykazała słabą zależność pomiędzy suplementacją witaminą C a zmniejszoną zachorowalnością na raka płuc[42]. Kolejna metaanaliza nie wykazała związku witaminy C z ryzykiem zachorowania na raka prostaty[39].
W celu oszacowania wpływu suplementacji witaminą C na zapadalność na nowotwór jelita grubego przeprowadzono dwie metaanalizy. Jedno z badań wykazało słabą zależność pomiędzy konsumpcją witaminy C a zmniejszoną zapadalnością na tę chorobę. Drugie nie wykazało takich zależności[43][44].
Analiza metadanych z 2011 nie potwierdziła, że witamina C zapobiega rozwojowi nowotworów piersi[45], ale kolejne badanie wykazało, że witamina C może mieć związek ze zwiększoną przeżywalnością u pacjentek już chorych[46].
Terapia nowotworów
Witamina C, podawana dożylnie w formie askorbinianu sodu, wykazuje działanie cytotoksyczne wobec nowotworów i jest wskazywana jako potencjalny lek przeciwnowotworowy. Autorzy uznali wyniki za obiecujące i uzasadniające kontynuowanie badań klinicznych[47][48][49].
Choroby układu krążenia
Metaanaliza z 2013 roku nie wykazała wpływu suplementacji witaminą C na zmniejszenie ryzyka zawału, wylewu, śmierci w wyniku choroby układu krążenia ani śmierci ogółem[50]. Kolejna analiza wykazała jednak odwrotną zależność pomiędzy witaminą C a ryzykiem wylewu[51].
Metaanaliza 44 badań klinicznych wykazała istotny pozytywny wpływ suplementacji dobowymi dawkami witaminy C powyżej 500 mg na funkcje śródbłonka. Wykazano, że efekt ten był silniejszy u osób o zwiększonym ryzyku zapadania na choroby układu krążenia[52].
Choroby przewlekłe
Nie wykazano wpływu suplementacji witaminą C na leczenie reumatoidalnego zapalenia stawów[53].
Badania badające wpływ witaminy C na rozwój choroby Alzheimera osiągnęły sprzeczne wyniki[54][55]. Utrzymywanie zdrowego spożycia witaminy C w diecie jest prawdopodobnie istotniejsze niż suplementacja[56].
Badanie efektu spożywania dawek witaminy C przekraczających RDA nie wykazało jej istotnego wpływu na zapobieganie i hamowanie rozwoju zaćmy starczej[57].
Przeziębienie
Wpływ witaminy C na leczenie przeziębienia był obiektem wielu badań naukowych. Wykazano, że nie jest ona skuteczna w zapobieganiu, czy leczeniu przeziębienia poza szczególnymi przypadkami (zwłaszcza u osób uprawiających intensywnie sport w zimnym otoczeniu)[58][59]. Rutynowa suplementacja witaminą C nie redukuje prawdopodobieństwa zachorowania ani nasilenia przeziębienia w ogólnej populacji, ale może zredukować długość trwania choroby[58][60].
COVID-19
Podanie dużych dawek askrobinianu sodu dożylnie wpływa pozytywnie na przebieg COVID-19 u osób zakażonych SARS-CoV-2. Zauważono lżejszy przebieg choroby i poprawę saturacji, kwestia wpływu na śmiertelność nie jest jasna i wymaga dalszych analiz[61][62][63].
Zastosowanie w przemyśle spożywczym
Kwas askorbinowy jest przeciwutleniaczem i jako taki jest szeroko stosowany w przemyśle spożywczym, podobnie jak jego sole i estry. Symbole stosowane do oznaczenia tych związków:
- E300 – kwas askorbinowy
- E301 – askorbinian sodu
- E302 – askorbinian wapnia
- E303 – askorbinian potasu
- E304 – estry kwasów tłuszczowych i kwasu askorbinowego
- E304(i) – palmitynian askorbylu
- E304(ii) – stearynian askorbylu
- E315 – kwas izoaskorbinowy (erytrobowy).
Historia
Symptomy szkorbutu opisane zostały po raz pierwszy w relacjach z wypraw krzyżowych. W czasach wielkich odkryć geograficznych (XV–XVI w.) stał się on główną przyczyną śmierci i kalectwa żeglarzy w długich rejsach. Dopiero w roku 1753 szkocki lekarz James Lind odkrył, że chorobie zapobiega i leczy spożywanie soku z owoców cytrusowych[64]. Na początku XX w. odkryto, że świnka morska jest także podatna na tę chorobę i może stanowić model zwierzęcy do jej badań. Umożliwiło to udowodnienie, że rzeczywiście podłożem szkorbutu jest niewłaściwa dieta[65].
Witaminę C wyizolował w 1928 roku węgierski biochemik Albert Szent-Györgyi z bydlęcej kory nadnerczy oraz z soku pomarańczowego i z soku z kapusty, a następnie z papryki. Wykazał, że wyodrębniony związek ma właściwości przeciwszkorbutowe i nadał mu nazwę „kwas heksauronowy” (hexuronic acid). W roku 1933 W.N. Haworth i E.L. Hirst ustalili jego strukturę, a ponadto Haworth oraz niezależnie T. Reichstein i współpracownicy opisali syntezę obu jego enancjomerów. W tym samym roku Szent-Györgyi i Haworth zaproponowali zmianę nazwy związku na „kwas askorbinowy”, aby zobrazować jego właściwości przeciwszkorbutowe[65]. W 1937 obu naukowcom za badania nad witaminą C przyznano Nagrody Nobla[65] – Szent-Györgyi otrzymał ją w dziedzinie fizjologii lub medycyny, a Haworth w dziedzinie chemii.
Uwagi
Przypisy
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6 .
- ↑ Farmakopea Polska VI, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2002, s. 1176, ISBN 83-88157-18-3 .
- ↑ Ascorbic acid, [w:] PubChem, United States National Library of Medicine, CID: 54670067 (ang.).
- ↑ a b c d e L-Kwas askorbinowy (nr A5960) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-06-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Kwas askorbinowy, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy (pol. • ang.).
- ↑ Kwas askorbinowy (nr A5960) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-06-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e Słownik tematyczny. Biologia, cz. 1, Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 21, ISBN 978-83-01-16529-1 .
- ↑ a b c d Manfred Eggersdorfer i współpr.: Vitamins. 10. Vitamin C (l-Ascorbic Acid). W: Ullmann’s Encyclopedia of Industrial Chemistry. Veinheim: Wiley-VCH Verlag, 2005, s. 110–123. DOI: 10.1002/14356007.a27_443. (ang.).
- ↑ PiotrP. Król PiotrP., Witamina C Lewoskrętna – Właściwości – Czy różni się od Prawoskrętnej? [online], Medicover, 21 czerwca 2018 [dostęp 2020-03-01] .
- ↑ a b DamianD. Parol DamianD., Lewoskrętna witamina C, damianparol.com, 19 czerwca 2016 [zarchiwizowane 2017-06-16] .
- ↑ ŁukaszŁ. Sakowski ŁukaszŁ., Czy lewoskrętna witamina C wyleczy raka, czyli jak szarlatani nabierają ludzi, CrazyNauka, 23 października 2016 [zarchiwizowane 2017-08-21] .
- ↑ John Henry Gaddum: Gaddum’s Pharmacology. A.S.V. Burgen, James Fabian Mitchell (redaktorzy). Wyd. 9. Oxford University Press, 1985, s. 136, seria: Oxford Medical Publications. ISBN 978-0-19-261423-0.
- ↑ a b c d e Barbara Bukała: Biologia. Fizjologia zwierząt z elementami fizjologii człowieka. Kraków: Wydawnictwo Szkolne Omega, 2005, s. 149–150. ISBN 83-7267-192-3.
- ↑ a b J.J.J.J. Burns J.J.J.J., Missing Step in Man, Monkey and Guinea Pig required for the Biosynthesis of L-Ascorbic Acid, „Nature”, 180 (4585), 1957, s. 553–553, DOI: 10.1038/180553a0 [dostęp 2024-04-15] (ang.).
- ↑ a b c d Marc Y.M.Y. Lachapelle Marc Y.M.Y., GuyG. Drouin GuyG., Inactivation dates of the human and guinea pig vitamin C genes, „Genetica”, 139 (2), 2011, s. 199–207, DOI: 10.1007/s10709-010-9537-x, PMID: 21140195 [dostęp 2024-04-15] (ang.).
- ↑ KonradK. Dabrowski KonradK., Gulonolactone Oxidase is Missing in Teleost Fish. The Direct Spectrophotometric Assay, „Biological Chemistry Hoppe-Seyler”, 371 (1), 1990, s. 207–214, DOI: 10.1515/bchm3.1990.371.1.207, PMID: 2340104 [dostęp 2024-04-15] (ang.).
- ↑ K.K. Dabrowski K.K., Primitive actimoterigian fishes can synthesize ascorbic acid, „Experientia”, 50 (8), 1994, s. 745–748, DOI: 10.1007/BF01919376 [dostęp 2024-04-15] (ang.).
- ↑ T.T. Reichstein T.T., A.A. Grüssner A.A., Eine ergiebige Synthese der l‐Ascorbinsäure (C‐Vitamin), „Helvetica Chimica Acta”, 17 (1), 1934, s. 311–328, DOI: 10.1002/hlca.19340170136 [dostęp 2024-04-15] (niem.).
- ↑ Vitamin C. W: P. E. Norris: About Vitamins: Nature’s Keys to Radiant Health. Richard Clay (The Chaucer Press), Ltd., 1982, s. 25. ISBN 0-7225-0803-4. (ang.).
- ↑ a b Anna Szczepańska, Anna Ners, Zofia Zawistowska: Kuchnia i zdrowie. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1988. ISBN 83-200-1072-1.
- ↑ Acerola (Malpighia glabra L., M. punicifolia M. emarginata DC.) Agriculture, Production, and Nutrition. W: Paul D. Johnson: Plants in Human Health and Nutrition Policy. T. 91. Karger Publishers, 2003, s. 63–74. ISBN 978-3-8055-7554-6. (ang.).
- ↑ Pummelo, raw, [w:] National Nutrient Database for Standard Reference Release 28 [online], United States Department of Agriculture [zarchiwizowane 2016-04-06] (ang.).
- ↑ Oranges, raw, all commercial varieties, [w:] National Nutrient Database for Standard Reference Release 28 [online], United States Department of Agriculture [zarchiwizowane 2016-04-06] (ang.).
- ↑ Lemons, raw, without peel, [w:] National Nutrient Database for Standard Reference Release 28 [online], United States Department of Agriculture [zarchiwizowane 2016-04-06] (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Beef Products, [w:] USDA Food Composition Databases [online], United States Department of Agriculture, Agricultural Research Service [zarchiwizowane 2018-08-23] (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Pork Products, [w:] USDA Food Composition Databases [online], United States Department of Agriculture, Agricultural Research Service [zarchiwizowane 2018-08-23] (ang.).
- ↑ a b Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Finfish and Shellfish Products, [w:] USDA Food Composition Databases [online], United States Department of Agriculture, Agricultural Research Service [zarchiwizowane 2018-08-23] (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Dairy and Egg Products, [w:] USDA Food Composition Databases [online], United States Department of Agriculture, Agricultural Research Service [zarchiwizowane 2018-08-23] (ang.).
- ↑ a b c d e f g h i Tablice biologiczne. Witold Mizerski (red.). Wyd. IV. Warszawa: Wydawnictwo Adamantan, 2004, s. 30–31. ISBN 83-7350-059-6.
- ↑ a b c d e f g h Biologia. Czesław Jura, Jacek Godula (redaktorzy). Wyd. VII (przekład). Warszawa: Multico Oficyna Wydawnicza, 2007, s. 889. ISBN 978-83-7073-412-1.
- ↑ a b c d e f g h Encyklopedia Biologia. Agnieszka Nawrot (red.). Kraków: Wydawnictwo GREG, s. 600. ISBN 978-83-7327-756-4.
- ↑ a b c d e f g h Biologia. Vademecum maturalne 2011. Monika Balcerowicz (red.). Gdynia: Operon, 2010, s. 219–221. ISBN 978-83-7680-166-7.
- ↑ a b c d e f g h i j Hans KonradH.K. Biesalski Hans KonradH.K. i inni, Żywienie: atlas i podręcznik, Wyd. 1. pol., dodr, Wrocław: Edra Urban & Partner, 2015, s. 164-165, ISBN 978-83-65195-27-2 [dostęp 2024-03-16] .
- ↑ Robert M.R.M. Douglas Robert M.R.M., HarriH. Hemilä HarriH., Vitamin C for Preventing and Treating the Common Cold, „PLoS Medicine”, 2 (6), 2005, art. nr e168, DOI: 10.1371/journal.pmed.0020168, PMID: 15971944, PMCID: PMC1160577 [dostęp 2024-04-15] (ang.).
- ↑ Vitamin and mineral requirements in human nutrition, 2nd edition. Światowa Organizacja Zdrowia, 2004. [dostęp 2010-02-08]. (ang.).
- ↑ HealthH. Canada HealthH., Vitamin C: Recommended Dietary Allowances, Health Canada, 13 września 2007 [zarchiwizowane 2008-05-16] (ang.).
- ↑ Biochemia stresu oksydacyjnego. Uniwersytet Jagielloński, Zakład Biotechnologii Medycznej. s. 39. [dostęp 2014-11-07].
- ↑ Table 3.2 Vitamin C intakes (expressed as mg/d) from food sources, [w:] Canadian Community Health Survey Cycle 2.2, Nutrition [online], Statistics Canada, 2004 [zarchiwizowane 2010-03-29] (ang.).
- ↑ a b J.J. Stratton J.J., M.M. Godwin M.M., The effect of supplemental vitamins and minerals on the development of prostate cancer: a systematic review and meta-analysis, „Family Practice”, 28 (3), 2011, s. 243–252, DOI: 10.1093/fampra/cmq115, PMID: 21273283 [dostęp 2024-04-15] (ang.).
- ↑ GoranG. Bjelakovic GoranG. i inni, Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases, „Cochrane Database of Systematic Reviews”, 2012 (3), 2012, art. nr CD007176, DOI: 10.1002/14651858.CD007176.pub2, PMID: 22419320, PMCID: PMC8407395 [dostęp 2024-04-15] (ang.).
- ↑ MarcelaM. Cortés-Jofré MarcelaM. i inni, Drugs for preventing lung cancer in healthy people, „Cochrane Database of Systematic Reviews”, 2020 (3), 2020, art. nr CD002141, DOI: 10.1002/14651858.CD002141.pub3, PMID: 32130738, PMCID: PMC7059884 [dostęp 2024-04-15] (ang.).
- ↑ JieJ. Luo JieJ., LiL. Shen LiL., DiD. Zheng DiD., Association between vitamin C intake and lung cancer: a dose-response meta-analysis, „Scientific Reports”, 4 (1), 2014, DOI: 10.1038/srep06161, PMID: 25145261, PMCID: PMC5381428 [dostęp 2024-04-15] (ang.).
- ↑ XiaodongX. Xu XiaodongX. i inni, Dietary intake of vitamins A, C, and E and the risk of colorectal adenoma: a meta-analysis of observational studies, „European Journal of Cancer Prevention”, 22 (6), 2013, s. 529–539, DOI: 10.1097/CEJ.0b013e328364f1eb, PMID: 24064545 [dostęp 2024-04-15] (ang.).
- ↑ D.D. Papaioannou D.D. i inni, Antioxidants in the chemoprevention of colorectal cancer and colorectal adenomas in the general population: a systematic review and meta-analysis: Antioxidant chemoprevention: meta-analysis, „Colorectal Disease”, 13 (10), 2011, s. 1085–1099, DOI: 10.1111/j.1463-1318.2010.02289.x, PMID: 20412095 [dostęp 2024-04-15] (ang.).
- ↑ HuH. Fulan HuH. i inni, Retinol, vitamins A, C, and E and breast cancer risk: a meta-analysis and meta-regression, „Cancer Causes & Control”, 22 (10), 2011, s. 1383–1396, DOI: 10.1007/s10552-011-9811-y, PMID: 21761132 [dostęp 2024-04-15] (ang.).
- ↑ Holly R.H.R. Harris Holly R.H.R., NicolaN. Orsini NicolaN., AlicjaA. Wolk AlicjaA., Vitamin C and survival among women with breast cancer: A Meta-analysis, „European Journal of Cancer”, 50 (7), 2014, s. 1223–1231, DOI: 10.1016/j.ejca.2014.02.013, PMID: 24613622 [dostęp 2024-04-15] (ang.).
- ↑ N.H.N.H. Riordan N.H.N.H. i inni, Intravenous ascorbate as a tumor cytotoxic chemotherapeutic agent, „Medical Hypotheses”, 44 (3), 1995, s. 207–213, DOI: 10.1016/0306-9877(95)90137-x, PMID: 7609676 (ang.).
- ↑ B.V. SunilB.V.S. Kumar B.V. SunilB.V.S., SatparkashS. Singh SatparkashS., RamneekR. Verma RamneekR., Anticancer potential of dietary vitamin D and ascorbic acid: A review, „Critical Reviews in Food Science and Nutrition”, 57 (12), 2017, s. 2623–2635, DOI: 10.1080/10408398.2015.1064086, PMID: 26479551 (ang.).
- ↑ GinaG. Nauman GinaG. i inni, Systematic Review of Intravenous Ascorbate in Cancer Clinical Trials, „Antioxidants”, 7 (7), 2018, DOI: 10.3390/antiox7070089, PMID: 30002308, PMCID: PMC6071214 (ang.).
- ↑ YizhouY. Ye YizhouY., JingJ. Li JingJ., ZhongxiangZ. Yuan ZhongxiangZ., Effect of Antioxidant Vitamin Supplementation on Cardiovascular Outcomes: A Meta-Analysis of Randomized Controlled Trials, „PLoS ONE”, 8 (2), 2013, art. nr e56803, DOI: 10.1371/journal.pone.0056803, PMID: 23437244, PMCID: PMC3577664 [dostęp 2024-04-15] (ang.).
- ↑ Guo‐ChongG.‐Ch. Chen Guo‐ChongG.‐Ch. i inni, Vitamin C Intake, Circulating Vitamin C and Risk of Stroke: A Meta‐Analysis of Prospective Studies, „Journal of the American Heart Association”, 2 (6), 2013, DOI: 10.1161/JAHA.113.000329, PMID: 24284213, PMCID: PMC3886767 [dostęp 2024-04-15] (ang.).
- ↑ Ammar W.A.W. Ashor Ammar W.A.W. i inni, Effect of vitamin C on endothelial function in health and disease: A systematic review and meta-analysis of randomised controlled trials, „Atherosclerosis”, 235 (1), 2014, s. 9–20, DOI: 10.1016/j.atherosclerosis.2014.04.004, PMID: 24792921 [dostęp 2024-04-15] (ang.).
- ↑ Cathy CregerC.C. Rosenbaum Cathy CregerC.C. i inni, Antioxidants and antiinflammatory dietary supplements for osteoarthritis and rheumatoid arthritis, „Alternative Therapies in Health and Medicine”, 16 (2), 2010, s. 32–40, PMID: 20232616 [zarchiwizowane 2016-04-26] .
- ↑ Georgina E.G.E. Crichton Georgina E.G.E., JanetJ. Bryan JanetJ., Karen J.K.J. Murphy Karen J.K.J., Dietary Antioxidants, Cognitive Function and Dementia - A Systematic Review, „Plant Foods for Human Nutrition”, 68 (3), 2013, s. 279–292, DOI: 10.1007/s11130-013-0370-0, PMID: 23881465 [dostęp 2024-04-15] (ang.).
- ↑ Feng-JiaoF.J. Li Feng-JiaoF.J., LiangL. Shen LiangL., Hong-FangH.F. Ji Hong-FangH.F., Dietary Intakes of Vitamin E, Vitamin C, and β-Carotene and Risk of Alzheimer's Disease: A Meta-Analysis, „Journal of Alzheimer's Disease”, 31 (2), 2012, s. 253–258, DOI: 10.3233/JAD-2012-120349, PMID: 22543848 [dostęp 2024-04-15] .
- ↑ Fiona E.F.E. Harrison Fiona E.F.E., A Critical Review of Vitamin C for the Prevention of Age-Related Cognitive Decline and Alzheimer's Disease, „Journal of Alzheimer's Disease”, 29 (4), 2012, s. 711–726, DOI: 10.3233/JAD-2012-111853, PMID: 22366772, PMCID: PMC3727637 [dostęp 2024-04-15] (ang.).
- ↑ Milan CM.C. Mathew Milan CM.C. i inni, Antioxidant vitamin supplementation for preventing and slowing the progression of age-related cataract, „Cochrane Database of Systematic Reviews”, 2012, art. nr CD004567, DOI: 10.1002/14651858.CD004567.pub2, PMID: 22696344, PMCID: PMC4410744 [dostęp 2024-04-15] (ang.).
- ↑ a b HarriH. Hemilä HarriH., ElizabethE. Chalker ElizabethE., Vitamin C for preventing and treating the common cold, „Cochrane Database of Systematic Reviews”, 2013 (5), 2013, art. nr CD000980, DOI: 10.1002/14651858.CD000980.pub4, PMID: 23440782, PMCID: PMC8078152 [dostęp 2024-04-15] (ang.).
- ↑ Kathryn A.K.A. Heimer Kathryn A.K.A. i inni, Examining the evidence for the use of vitamin C in the prophylaxis and treatment of the common cold, „Journal of the American Academy of Nurse Practitioners”, 21 (5), 2009, s. 295–300, DOI: 10.1111/j.1745-7599.2009.00409.x, PMID: 19432914, PMCID: PMC7166744 [dostęp 2024-04-15] (ang.).
- ↑ HarriH. Hemilä HarriH., Vitamin C and Infections, „Nutrients”, 9 (4), 2017, DOI: 10.3390/nu9040339, ISSN 2072-6643, PMID: 28353648, PMCID: PMC5409678 [dostęp 2017-09-27] .
- ↑ HarriH. Hemilä HarriH., AnitraA. Carr AnitraA., ElizabethE. Chalker ElizabethE., Vitamin C May Increase the Recovery Rate of Outpatient Cases of SARS-CoV-2 Infection by 70%: Reanalysis of the COVID A to Z Randomized Clinical Trial, „Frontiers in Immunology”, 12, 2021, DOI: 10.3389/fimmu.2021.674681, PMID: 34040614, PMCID: PMC8141621 [dostęp 2021-09-02] (ang.).
- ↑ DengfengD. Gao DengfengD. i inni, The efficiency and safety of high-dose vitamin C in patients with COVID-19: a retrospective cohort study, „Aging”, 13 (5), 2021, s. 7020–7034, DOI: 10.18632/aging.202557, PMID: 33638944, PMCID: PMC7993712 [dostęp 2021-09-02] (ang.).
- ↑ JingJ. Zhang JingJ. i inni, Pilot trial of high-dose vitamin C in critically ill COVID-19 patients, „Annals of Intensive Care”, 11 (1), 2021, s. 5, DOI: 10.1186/s13613-020-00792-3, PMID: 33420963, PMCID: PMC7794643 [dostęp 2021-09-02] (ang.).
- ↑ scurvy, [w:] Encyclopædia Britannica [dostęp 2018-02-16] (ang.).
- ↑ a b c Bernd Oster, Ulrich Fechtel: Vitamins. Vitamin C. History. W: Ullmann’s Encyclopedia of Chemical Industrial Chemistry. Weinheim: Wiley-VCH Verlag, 2005, s. 111. DOI: 10.1002/14356007.a27_443. ISBN 978-3-527-30673-2.
 Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
- p
- d
- e
- p
- d
- e
| A11C – Witaminy A i D (włącznie z preparatami zawierającymi obydwie witaminy) |
| ||||
|---|---|---|---|---|---|
| A11D – Witamina B1 (włącznie z preparatami złożonymi zawierającymi witaminę B6 i B12) |
| ||||
| A11G – Kwas askorbinowy (włącznie z preparatami złożonymi) |
| ||||
| A11H – Preparaty proste zawierające inne witaminy |
|
- p
- d
- e
| G01A – Leki przeciwzakaźne i antyseptyczne (bez połączeń z kortykosteroidami) |
|
|---|
- p
- d
- e
| S01A – Leki stosowane w zakażeniach oczu |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S01B – Leki przeciwzapalne |
| ||||||||||||
| S01C – Połączenia leków przeciwzapalnych z przeciwinfekcyjnymi |
| ||||||||||||
| S01E – Leki stosowane w jaskrze i zwężające źrenicę |
| ||||||||||||
| S01F – Leki rozszerzające źrenicę |
| ||||||||||||
| S01G – Leki zmniejszające przekrwienie oraz przeciwalergiczne |
| ||||||||||||
| S01H – Środki znieczulające miejscowo |
| ||||||||||||
| S01J – Preparaty diagnostyczne |
| ||||||||||||
| S01K – Preparaty pomocnicze w chirurgii oka |
| ||||||||||||
| S01L – Leki stosowane w leczeniu zaburzeń naczyniowych oka |
| ||||||||||||
| S01X – Pozostałe leki oftalmologiczne |
|
 | Zobacz kolekcję cytatów na temat witaminy C w Wikicytatach |















